研究テーマ
複雑な脳のしくみを理解すべく新しいシナプス学の探究
脳内の神経細胞どうしをつなぐ神経「シナプス」は,細胞間の情報伝達の場であるだけでなく,記憶や学習,そして種々の精神神経疾患の病態発現に関わる重要な部位として精力的に研究されています。近年,シナプスは経験や学習などの外的環境に応じて絶えず改変される (シナプス可塑性) ことがわかってきました。しかし,生涯を通じて恒常的に観察されるシナプス可塑性が脳内でどのように誘発され,記憶・学習をはじめとする個体行動レベルの事象において何をコードしているのか,さらには,シナプスの異常が各疾患に対してどのように関与しているのかといった根本的な問いについては,今も尚、不明な点が数多く残されています (図1)。私たちは,記憶・学習過程の分子的理解,そして,シナプスが関わる疾患 (シナプス病) の病態解明・治療法開発をめざし,電気生理学とマウス行動学をもとに,新規技術を駆使した独自のシナプス学 (synaptology) 研究を展開しています (研究1-6)。
研究1. シナプス形成・可塑性を担う新しい分泌因子の同定と臨床開発への応用
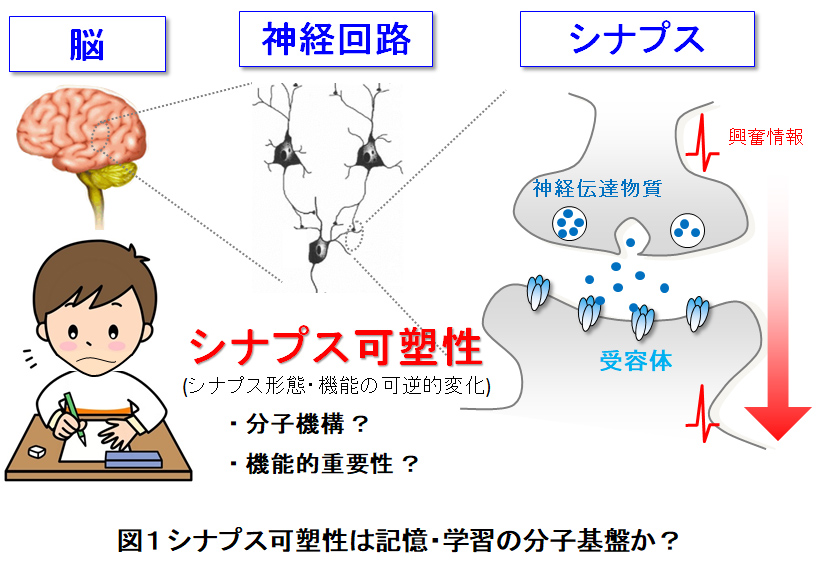
私たちはこれまで,米国St.Jude Children's Hospital(Yuzaki M. Lab), および, 慶應義塾大学医学部(柚﨑通介研究室)において,自然免疫系補体C1qやC1qの機能領域を有するC1qファミリー分子が,シナプスの形成・機能を制御する新しい分泌型シナプス形成因子 (分泌型シナプスオーガナイザー) として働くことを見出してきました (図2; Cell Rep, '24; Science '16, '10; Neuron '19, '16, '15)。分泌された同分子はシナプス後部に発現する特異的受容体と前部に局在する接着分子と三者複合体を構築することでサンドイッチ型のシナプス架橋構造をとることを実証し,この構造に異常を有するヒト家系が重篤な記憶障害を呈すことを明らかにしました (未発表データ; Neurology '13)。これらの知見をもとに,シナプス形成を人為的に誘導する人工シナプスコネクター分子を設計し,シナプス不全に起因する各種病態モデル動物の病的表現型の改善にも成功しています (Science '20, 慶應義塾大・愛知医科大・英国MRC分子生物学研究所・独国神経変性疾患研究センターとの国際共同研究)。
研究2. 神経膠細胞によるシナプス可塑性および記憶・学習制御機構の解明
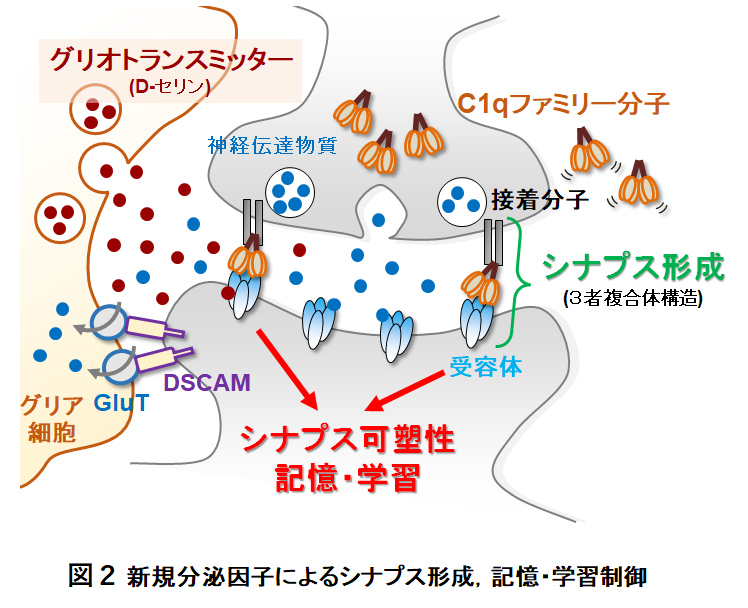
神経細胞の脇役として軽視されてきた神経膠(グリア)細胞が,神経細胞と同じリガンド作動性受容体を発現し,神経伝達物質との結合によって活性化される「ニューロン-グリア相互作用」の重要性を世界に先駆けて提唱しました (Science '01, 群馬大学医学部・小澤瀞司研究室での研究成果)。とりわけ,神経活動に応じてグリア細胞表面に発現する受容体が活性化されると,D-セリンをはじめとするグリア由来分泌因子 (グリオトランスミッター) が放出され,シナプス可塑性や記憶・学習過程を動的に調節することを解明しました (図2; Nat Neurosci '11)。また最近,神経細胞由来の接着分子 (DSCAM) がグリア型グルタミン酸輸送体 (GluT) とのトランス結合による新たなニューロン-グリア相互作用を同定し,シナプスにおける神経伝達物質 (Glu) の回収効率を制御する新しい仕組みを報告しました (図2; Nat Commun '23, 国立精神神経センター・星野幹雄先生らとの共同研究)。
研究3. シナプス可塑性を時空間的に操作しうる光遺伝学技術の開発と記憶・学習制御
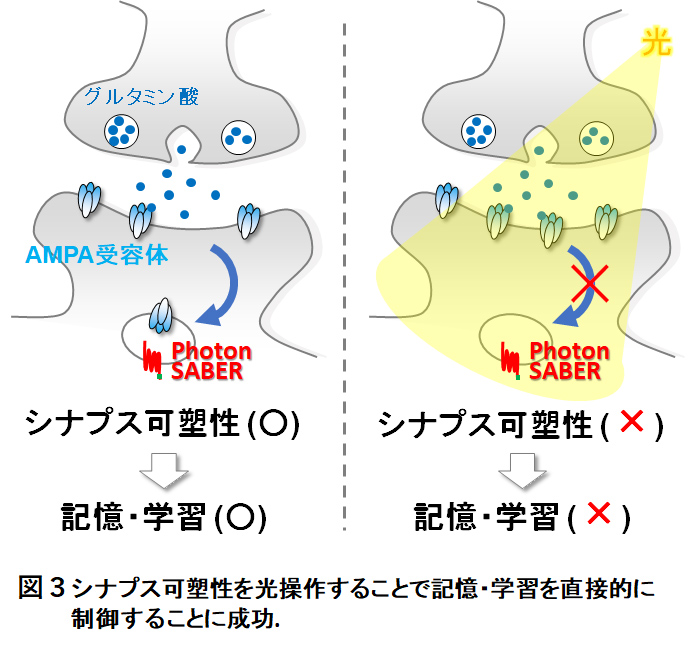
小脳や海馬などの中枢神経系で観察される機能的シナプス可塑性 (シナプス伝達効率の可逆的変化) が,シナプス伝達を担うAMPA型グルタミン酸受容体 (AMPA受容体) の数の変化によって生じることを見出しました (J Physiol '19; PNAS '13, '05; Neuron '12など)。また,AMPA受容体のエンドサイトーシスを可逆的に光操作しうる新しい光遺伝学ツール (PhotonSABER) を開発し,マウス小脳でのシナプス可塑性や運動記憶・学習を時空間的に制御することに成功しました (図3; Neuron '18, 名古屋工業大学・神取秀樹先生,電気通信大学・松田信爾先生らとの共同研究)。これらの結果をもとに,シナプス可塑性と記憶・学習との直接的な因果関係を実証することができました。現在、LTDの逆過程である長期増強現象(long-term potentiation, LTP)を伴うAMPA受容体動態(エキソサイトーシス)を操作できる新規光遺伝学技術の開発を展開しています(論文投稿準備中)。
研究4. イオンチャネル型グルタミン酸受容体のチャネル活動非依存的機能の解明
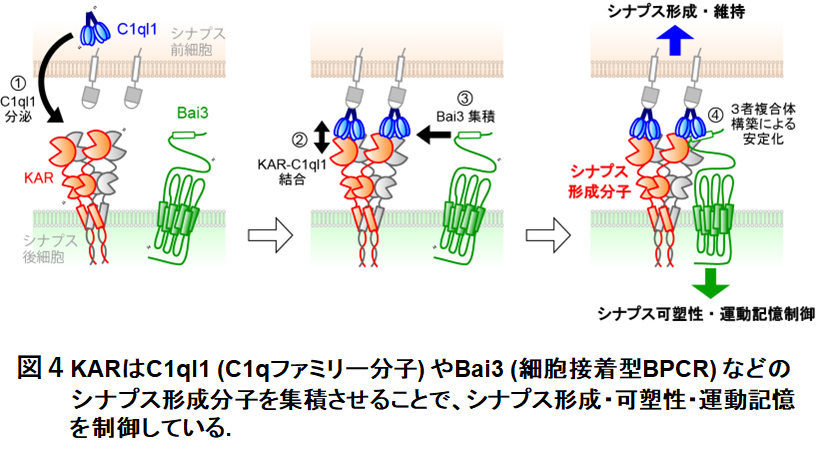
中枢シナプスにおける速い興奮性伝達を担うイオンチャネル型グルタミン酸受容体 (iGluR) は,記憶・学習の形成過程や種々の神経系疾患に関与する重要なリガンド作動性チャネルとして知られています。近年では,iGluRがチャネル活動を伴わずに機能する「非チャネル活動」の存在が次々と報告されており,その分子機構や機能的役割について精力的に研究されています。私たちは,運動記憶を支える小脳神経回路において,iGluRファミリーに属するカイニン酸型グルタミン酸受容体 (KAR) がチャネル活動に依存せず,C1qファミリー分子やBai3 (Brain-specific angiogenesis inhibitor 3, 細胞接着型GPCRの1種) などのシナプス構成分子を集積させる,いわゆる,シナプス―オーガナイザーとして働いていることを見出しました (図4; Cell Rep '24, スペイン国立研究評議会-ミゲル・エルナンデス大・Juan Lerma先生らとの共同研究; Neuron '15)。この活動様式が損なわれると,小脳回路のシナプス可塑性が障害され,また,小脳依存的な運動記憶・学習が著しく低下しました。KAR-C1qファミリー分子-Bai3複合体は,小脳に限らず,脳内のさまざまな領域に発現し機能している可能性が示唆されています。今後,本成果を踏まえ,iGluRの新しい活動様式の理解を深めていきます。
研究5. 脳神経機能を解き明かすための新規ニューロケミカルバイオロジー技術の開発
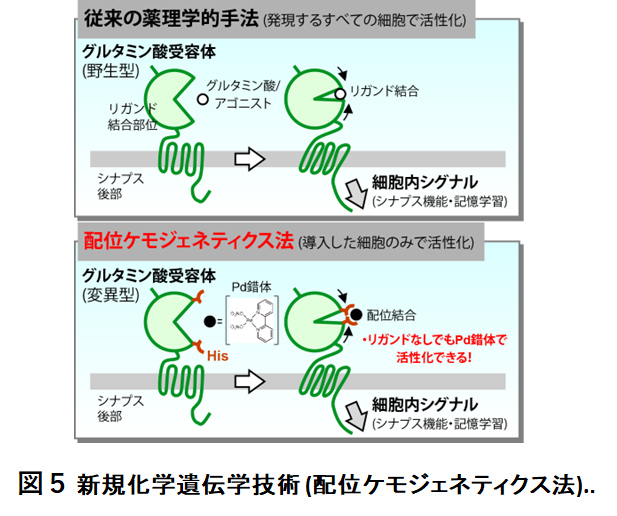
京都大学(工学部・浜地格研究室,野中洋研究室)および名古屋大学(工学部・清中茂樹研究室)と連携し,脳神経機能を理解するための新しいケミカルバイオロジー (ニューロケミカルバイオロジー) 技術の創製に資する研究を行っています (PNAS '24, Chem '23, Nat Commun '22 など)。その成果として,細胞膜表面に局在するリガンド作動性受容体を生きたまま化学修飾しうる手法 (リガンド指向性化学) を開発し,表面AMPA受容体に蛍光色素を付加することで,内在性の受容体動態をより正確に可視化することに成功しました (PNAS '24; Nat Commun '17)。また,この手法はマウス脳内で発現する様々な内在性リガンド受容体に適用可能であり,内在性シナプス受容体の局在様式を標識できる画期的なin vivoラベリング技術として報告しました (PNAS '24)。さらに,錯体化合物に特有な配位結合を利用し,シナプス機能や可塑性を担うリガンド作動性受容体を合成化合物投与で可逆的に活性化しうる配位ケモジェネティクス法を確立しました (図5; Nat Commun '22)。
これまでの研究を通じて,私たちは米国・英国・独国・仏国をはじめとする多数の海外研究機関と積極的に共同研究を行ってきました。また,国内においても,医学部(基礎・臨床)や工学部の先生方のみならず,各種研究機関の研究者とも連携し,学際的な研究活動を展開しています。今後は,これまでのシナプス研究で培った知識や経験を踏まえ,記憶・学習や精神神経疾患に寄与するシナプスを基礎生物学研究の実験対象とし,シナプスの形成・動作原理を分子レベルで理解し,それらの分子や反応経路を時空間的に操作できる新たな技術を開発・駆使することで,シナプスに秘められた数多の謎を解き明かします。
知的好奇心に満ち溢れた学生たちよ!若さと情熱を武器に、一緒に神経科学研究を楽しみましょう。
活動実績
代表的な発表論文
・Kakegawa, W.*, # (*co-first authors; #three co-corresponding authors), Paternain, A.V.*, Matsuda, K., Aller, M.I., Iida, I., Miura, E., Nozawa, K., Yamasaki, T., Sakimura, K., Yuzaki, M.#, Lerma, J.#: Kainate receptors regulate synaptic integrity and plasticity by forming a complex with synaptic organizers in the cerebellum. Cell Reports 43(7) 114427 (2024).
・Dewa, K., Arimura, N., Kakegawa, W., Itoh, M., Adachi, T., Miyashita, S., Inoue, Y.U., Hizawa, K., Hori, K., Honjoya, N., Yagishita, H., Taya, S., Miyazaki, T., Usui, C., Tatsumoto, S., Tsuzuki, A., Uetake, H., Sakai, K., Yamakawa, K., Sasaki, T., Nagai, J., Kawaguchi, Y., Sone, M., Inoue, T., Go, Y., Ichinohe N., Kaibuchi, K., Watanabe, T., Koizumi, S., Yuzaki, M., Hoshino, M.: Neuronal DSCAM regulates the peri-synaptic localization of GLAST in Bergmann glia for functional synapse formation. Nature Communications 15; 485 (open access) (2024).
・Nonaka, H., Sakamoto, S., Shiraiwa, K., Ishikawa, M., Tamura, T., Okuno, K., Kondo, T., Kiyonaka, S., Susaki, A.E., Shimizu, C., Ueda, R.H., Kakegawa, W., Arai, I., Yuzaki, M., Hamachi, I.: Bioorthogonal chemical labeling of endogenous neurotransmitter receptors in living mouse brains. Proc. Natl. Acad. Sci. USA 121; e2313887121 (open access) (2024).
・Itoh, M.*, Piot, L.*, Mony, L., Paoletti, P., Yuzaki, M. (*co-first authors): Lack of evidence for direct ligand-gated ion channel activity of GluD receptors. Proc. Natl. Acad. Sci. USA 121;31 (open access) (2024).
・Ojima, K.*, Kakegawa, W.* (*co-first authors), Yamasaki, T., Miura, Y., Itoh, M., Michibata, Y., Kubota, R., Doura, T., Miura, E., Nonaka, H., Mizuno, S., Takahashi, S., Yuzaki, M., Hamachi, I., Kiyonaka, S.: Coordination chemogenetics for direct activation of GPCR-type glutamate receptors in brain tissue. Nature Communications 13: 3167 (open access) (2022).
・Kawamura, A., Katayama, Y., Kakegawa, W., Ino, D., Nishiyama, M., Yuzaki, M., Nakayama, K.I.: The autism-associated protein CHD8 is required for cerebellar development and motor function. Cell Reports 35 (1): 108932 (open access) (2021).
・Suzuki, K., Elegheert, J., Song, I., Sasakura, H., Senkov, O., Matsuda, K., Kakegawa, W., Clayton, J.A., Chang, T.V., Ferrer-Ferrer, M., Miura, E., Kaushik, R., Ikeno, M., Morioka, Y., Takeuchi, Y., Shimada, T., Otsuka, S., Stoyanov, S., Watanabe, M., Takeuchi, K., Dityatev, A., Aricescu, R.A., Yuzaki, M.: A synthetic synaptic organizer protein restores glutamatergic neuronal circuits. Science (Research Article) 369 (6507): eabb4853 (2020).
・Kono, M.*, Kakegawa, W.* (*co-first authors), Yoshida, K., Yuzaki, M.: Interneuronal NMDA receptors regulate long-term depression and motor learning in the cerebellum. The Journal of Physiology (London) 597: 903-920 (2019).
・Kakegawa, W., Katoh, A., Narumi, S., Miura, E., Motohashi, J., Takahashi, A., Kohda, K., Fukazawa, Y., Yuzaki, M., Matsuda, S.: Optogenetic control of synaptic AMPA receptor endocytosis reveals roles of LTD in motor learning. Neuron 99: 985-998 (2018).
・Hamoud, N., Tran, V., Aimi, T., Kakegawa, W., Lahaie, S., Thibault, M.P., Pelletier, A., Wong, G.W., Kim, I.S., Kania, A., Yuzaki, M., Bouvier, M., Cote, J.F.: Spatiotemporal regulation of G-protein coupled receptor BAI3 canonical and non-canonical signaling by C1q-like proteins and Stabilin-2 controls myoblast fusion. Nature Communications 9: 4470 (open access) (2018).
・Itoh, M., Yamashita, M., Kaneko, M., Okuno, H., Abe, M., Yamazaki, M., Natsume, R., Yamada, D., Kaizuka, T., Suwa, R., Sakimura, K., Sekiguchi, M., Wada, K., Hoshino, M., Mishina, M., Hayashi, T.: Deficiency of AMPAR‒Palmitoylation Aggravates Seizure Susceptibility. The Journal of Neuroscience 38; 10220 (open access) (2018).
・Wakayama, S., Kiyonaka, S., Arai, I., Kakegawa, W., Matsuda, S., Ibata, K., Nemoto, Y.L., Kusumi, A., Yuzaki, M., Hamachi, I.: Chemical labeling for visualizing native AMPA receptors in live neurons. Nature Communications 8: 14850 (open access) (2017).
・Elegheert, J., Kakegawa, W., Clay, E. J., Shanks, N., Behiels, E., Matsuda, K., Kohda, K., Miura, E., Rossmann, M., Mitakidis, N., Motohashi, J., Chang, T.V., Siebold, C., Greger, H.I., Nakagawa, T., Yuzaki, M., Aricescu, R.A.: Structural basis for integration of GluD receptors within synaptic organizer complexes. Science 353: 295-299 (2016).
・Matsuda, K., Budisantoso, T., Mitakidis, N., Sugaya, Y., Miura, E., Kakegawa, W., Yamasaki, M., Konno K., Uchigashima, M., Abe, M., Watanabe, I., Kano, M., Watanabe, M., Sakimura, K., Aricescu, R.A., Yuzaki, M.: Transsynaptic modulation of kainite receptor functions by C1q-like proteins. Neuron 90: 752-767 (2016).
・Kakegawa, W., Mitakidis, N., Miura, E., Abe, M., Matsuda, K., Takeo, Y.H., Kohda, K., Motohashi, J., Takahashi, A., Nagao, S., Muramatsu, S., Watanabe, M., Sakimura, K., Aricescu, A.R., Yuzaki, M.: Anterograde C1ql1 signaling is required in order to determine and maintain a single-winner climbing fiber in the mouse cerebellum. Neuron 85: 316-329 (2015).
・Matsuda, S., Kakegawa, W., Budisantoso, T., Nomura, T., Kohda, K., Yuzaki, M.: Stargazin regulates AMPA receptor trafficking through adaptor protein complexes during long-term depression. Nature Communications 4, 2759 (2013).
・Kohda, K.*, Kakegawa, W.* (*co-first authors), Matsuda, S., Yamamoto, T., Hirano, H., Yuzaki, M.: The delta2 glutamate receptor gates long-term depression by coordinating interactions between two AMPA receptor phosphorylation sites. Proc. Natl. Acad. Sci. USA 110: E948-957 (2013).
・Unoki, T.*, Matsuda, S.*, Kakegawa, W.* (*three co-first authors), Bich Van, N.T., Kohda, K., Suzuki, A., Funakoshi, Y., Hasegawa, H., Yuzaki, M., Kanaho, Y.: NMDA receptor-mediated activation of PI(4,5)P2-producing enzyme PIP5K is essential for AMPA receptor endocytosis during long-term depression. Neuron 73: 135-148 (2012).
・Kakegawa, W., Miyoshi, Y., Hamase, K., Matsuda, S., Matsuda, K., Kohda, K., Emi, K., Motohashi, J., Konno, R., Zaitsu, K., Yuzaki, M.: D-Serine regulates cerebellar LTD and motor coordination through the delta2 glutamate receptor. Nature Neuroscience 14: 603-611 (2011).
・Matsuda, K., Miura, E., Miyazaki, T., Kakegawa, W., Emi, K., Narumi, S., Fukazawa, Y., Shigemoto, R., Ito-Ishida, A., Kondo, T., Watanabe, M., Yuzaki, M.: Cbln1 is a ligand for an orphan glutamate receptor delta2, a bidirectional synapse organizer. Science 328: 363-368 (2010).
・Kakegawa, W., Miyazaki, T., Kohda, K., Matsuda, K., Emi, K., Motohashi, J., Watanabe, M., Yuzaki, M.: The N-terminal domain of GluRD2 (GluRdelta2) recruits presynaptic terminals and regulates synaptogenesis in the cerebellum in vivo. The Journal of Neuroscience 29: 5738-5748 (2009).
・Kakegawa, W., Miyazaki, T., Emi, K., Matsuda, K., Kohda, K., Motohashi, J., Mishina, M., Watanabe, M., Yuzaki, M.: Differential regulation of synaptic plasticity and cerebellar motor learning by the C-terminal PDZ-binding motif of GluRdelta2. The Journal of Neuroscience 28: 1460-1468 (2008).
・Matsuda, S., Miura, E., Matsuda, K., Kakegawa, W., Kohda, K., Watanabe, M., Yuzaki, M.: Accumulation of AMPA receptors in autophagosomes in neuronal axons lacking adaptor protein AP-4. Neuron 57: 730-745 (2008).
・Kakegawa, W., Kohda, K., Yuzaki, M.: The delta2 'ionotropic' glutamate receptor functions as a non-ionotropic receptor to control cerebellar synaptic plasticity. The Journal of Physiology (London) 584: 89-96 (2007).
・Kakegawa, W., Miyazaki, T., Hirai, H., Motohashi, J., Mishina, M., Watanabe, M., Yuzaki, M.: Ca2+ permeability of the channel pore is not essential for the delta2 glutamate receptor to regulate synaptic plasticity and motor coordination. The Journal of Physiology (London) 579: 729-735 (2007).
・Kakegawa, W., Yuzaki, M.: A mechanism underlying AMPA receptor trafficking during cerebellar long-term potentiation. Proc. Natl. Acad. Sci. USA 102: 17846-17851 (2005).
・Kakegawa, W., Tsuzuki, K., Yoshida, Y., Kameyama, K., Ozawa, S.: Input- and subunit-specific AMPA receptor trafficking underlying long-term potentiation at hippocampal CA3 synapses. European Journal of Neuroscience 20: 101-110 (2004).
・Kakegawa, W., Tsuzuki, K., Iino, M., Ozawa, S.: Functional NMDA receptor channels generated by NMDAR2B gene transfer in rat cerebellar Purkinje cells. European Journal of Neuroscience 17: 887-891 (2003).
・Kakegawa, W., Yamada, N., Iino, M., Kameyama, K., Umeda, T., Tsuzuki, K., Ozawa, S.: Postsynaptic expression of a new calcium pathway in hippocampal CA3 neurons and its influence on mossy fiber long-term potentiation. The Journal of Neuroscience 22: 4312-4320 (2002).
・Iino, M., Goto, K., Kakegawa, W., Okado, H., Sudo, M., Ishiuchi, S., Miwa, A, Takayasu, Y., Saito, I., Tsuzuki, K., Ozawa, S.: Glia-synapse interaction through Ca2+-permeable AMPA receptors in Bergmann glia. Science 292: 926-929 (2001).
プロフィール/メンバー
教授
掛川 渉 (Wataru Kakegawa) Researchmap

教授経歴
1993.04-1997.03 群馬大学 工学部 応用化学・材料工学科
1997.04-1999.03 群馬大学 大学院工学研究科 博士前期課程 (修士(工学))
1999.04-2003.03 群馬大学 大学院医学系研究科 博士課程 (博士(医学))
2003.04-2004.03 日本学術振興会 特別研究員DC2・PD (~2004.03)
2003.05-2004.03 米国St. Jude Children's Research Hospital, Department of Developmental Neurobiology 博士研究員
2004.04-2007.03 慶應義塾大学 医学部 生理学教室 助手
2007.04-2011.03 理化学研究所 脳科学総合研究センター 客員研究員
2007.04-2011.09 慶應義塾大学 医学部 生理学教室 助教
2011.10-2016.06 慶應義塾大学 医学部 生理学教室 専任講師
2016.07-2025.03 慶應義塾大学 医学部 生理学教室 准教授
2018.10-2025.03 科学技術振興機構 戦略的創造研究推進事業 (JST-ERATO)浜地ニューロ分子技術プロジェクト 慶應義塾大拠点グループリーダー
2025.04-現在 学習院大学 理学部 生命科学科 神経生理学教室 教授
2025.04-現在 慶應義塾大学 ヒト生物学-微生物叢-量子計算研究センター 訪問教授
受賞歴
2003年 群馬大学大学院医学系研究科学術優秀賞
2006年 U.S.-Japan Brain Research Cooperative Program Workshop Best Poster Award
2006年 日本神経科学学会奨励賞
2008年 日本生理学会奨励賞
2011年 慶應義塾大学医学部三四会奨励賞
2012年 文部科学大臣賞表彰若手科学者賞
2013年 日本生理学会入澤宏・彩記念若手研究奨励賞
2014年 D-アミノ酸学会奨励賞
2016年 坂口光洋記念慶應義塾医学振興基金医学研究奨励賞
2019年 日本学術振興会特別研究員等審査会専門委員表彰
2024年 慶應医学会野村達次賞
所属学会
日本神経科学学会(ホームページ委員会委員長・評議員)
日本生理学会(評議員)
Society for Neuroscience (Regular member)
D-アミノ酸学会(実行委員会委員)
助教
伊藤 政之(Masayuki Itoh) Researchmap

助教経歴
1997.04-2001.03 東邦大学 理学部 生物分子科学科
2001.04-2003.03 東邦大学 大学院理学研究科 生物分子科学専攻 修士課程 (修士(理学))
2003.04-2006.03 東邦大学 大学院理学研究科 生物分子科学専攻 博士課程 (博士(理学))
2003.04-2006.03 日本学術振興会 特別研究員DC1
2006.04-2009.03 生理学研究所 神経機能素子研究部門 非常勤研究員
2009.04-2011.04 自治医科大学 医学部 生理学講座 生物物理学部門 ポスト・ドクター
2011.04-2016.05 久留米大学 医学部 生理学講座 統合自律機能部門 助教
2016.06-2019.03 国立精神・神経医療研究センター 神経研究所 病態生化学研究部 科研費研究員
2019.04-2025.03 慶應義塾大学 医学部 生理学教室 特任助教
2025.04-現在 学習院大学 理学部 生命科学科 神経生理学教室 助教
2025.04-現在 慶應義塾大学 ヒト生物学-微生物叢-量子計算研究センター 訪問助教
所属学会
日本神経科学学会(一般会員・選挙管理委員会委員)
日本生理学会(一般会員)
日本生化学会(一般会員)
研究員
秘書 尾﨑 弓月(Yutsuki Ozaki)
大学院生
M2 尾形 麻友(Mayu Ogata)
M2 田代 百美(Momomi Tashiro)
M2 末吉 健朗(Takeaki Sueyoshi)
M1 髙橋 みなみ(Minami Takahashi)
学部生
B4 岩城 百華(Moka Iwaki)
B4 住友 陽太(Yota Sumitomo)
B4 樋口 史緒(Shio Higuchi)
B4 藤井 湧大(Yudai Fujii)
B4 松平 紗英子(Saeko Matsudaira)

2025年度 掛川研究室メンバー
連絡先
住所
〒171-8588 東京都豊島区目白1−5−1
学習院大学 理学部 生命科学科
神経生理学(掛川研究室)


