研究テーマ
タンパク質の巧妙な働きに遺伝子操作と構造解析で迫る
生命活動を担う最も基本的な分子であるタンパク質の構造と機能について、遺伝子工学ならびにX線結晶構造解析の手法などを用いて研究しています。主な研究対象は、抗生物質の生合成に関わる酵素、タンパク質分解酵素(プロテアーゼ)とその阻害剤(インヒビター)、タンパク質の立体構造形成を補助する分子シャペロン、そして繊維状集合体を形成するαへリックスなどで、それらの構造と機能の相関関係を明らかにすることを目標としています。
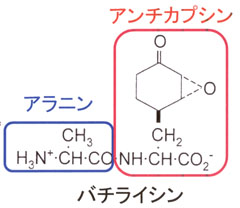
抗生物質バチライシンの構造式

21残基のα3ペプチドが形成した繊維状
集合体の電子顕微鏡による観察図
抗生物質の生合成に関わる酵素の構造と機能
抗生物質は微生物の生育を阻止あるいは殺す物質で、様々な生物種から様々な構造をもつ物質が単離されています。アオカビ由来のペニシリンが特に有名な例で、抗生物質の発見は人類に大きく貢献してきました。それぞれの抗生物質について、標的となるタンパク質(酵素)を明らかにすることにより、その抗生物質の作用機序に関する分子機構が解明されています。たとえばペニシリンは細胞壁の、ストレプトマイシンはリボソームが関与するタンパク質の合成を抑制します。これら抗生物質の中で薬として使用されているものの多くは、有機化学的手法により合成されていますが、それらを合成する各生物種では、細胞内で様々な酵素が働くことにより合成されています。そこで、いくつかの抗生物質について、それらの細胞内での合成(生合成)に関わる酵素の働きを分子レベルで解明するために、遺伝子工学、立体構造解析などの手法を用いて解析を進めています。また、これらの酵素の改変により、活性が上昇した抗生物質や、新規な作用機序を示す抗生物質の創製が可能となるかもしれません。
(1)枯草菌由来のバチライシンの生合成に関わる酵素の構造と機能
バチライシンは枯草菌由来の抗生物質で、上記のような構造を持ち、L-アラニンとL-アンチカプシンがATP依存的に酵素によって連結されて生合成されています。この反応に関わる酵素はYwfE(あるいはBacD)と呼ばれ、2種類のL-アミノ酸を認識し、ATPを用いて連結反応を触媒しています。その反応機構やアミノ酸の認識機構を明らかにするために、この酵素の立体構造の解明を進めています。合わせて、アミノ酸置換導入による基質特異性の改変の可能性なども探っています。一方、L-アンチカプシンは、チロシンなどの生合成前駆体であるプレフェン酸から数種類の酵素により生合成されることが分かっていますが、詳しい経路については不明な点が多く残されています。そこで、その生合成経路や各酵素が触媒する反応の詳細の解明を目指しています。
(2)ペプチド性抗生物質の生合成経路におけるアミノ酸翻訳後修飾に関わる酵素の構造と機能
抗生物質の中には、遺伝子から合成されたペプチドに翻訳後修飾が施されることによって、抗生物質としての働きを発揮するものがあります。それら翻訳後修飾に関わる酵素について、その働きを分子レベルで理解するために、それらの酵素の立体構造および反応機構の解明を目指しています。
プロテアーゼとその阻害剤(インヒビター)の構造と機能
プロテアーゼは、タンパク質代謝のみならず、細胞内シグナル伝達やアルツハイマー病など様々な病気の発症に深く関わっており、創薬の対象としても重要なタンパク質です。そこで、いくつかのプロテアーゼとそれらに特異的に結合する様々なインヒビターについて、その作用機序を分子レベルで詳細に理解するために、遺伝子工学、立体構造解析、ペプチド合成などの手法を用いて解析を進めています。特にタンパク質性のプロテアーゼインヒビターは、タンパク質でありながらプロテアーゼによって分解されるどころか、それらの働きを抑えてしまう、というユニークなタンパク質です。現在、下記に示すようなテーマで研究を進めています。
(1)ファージディスプレー法を用いた新規ペプチド性プロテアーゼインヒビターの創製
ファージとはバクテリアに感染するウイルスですが、その遺伝子を加工することによって、ファージ粒子のコートタンパク質に異種タンパク質やペプチドを提示することができます。提示する部分の配列をランダムにすることによって、そのライブラリーの中から新規な機能性タンパク質あるいはペプチドを見出すことが可能です。この手法を用いて、ズブチリシンに対して阻害活性を示す12残基のペプチドを見出すことができたので、そのペプチドについてさらに詳しく解析を進めています。
(2)新規な阻害様式を示すプロテアーゼインヒビターについての解析
ヒラタケ由来のPOIA1や酵母由来のYIB2は、他のセリンプロテアーゼインヒビターに相同性がなく、またカルボキシぺプチダーゼで処理すると阻害活性が消失することから、C末端領域がプロテアーゼとの結合に重要であると考えられます。実際にこれらのインヒビターのC末端領域の配列を改変すると、阻害作用に変化が見られます。このようなことから、これらのインヒビターはこれまでにないユニークな阻害様式を示すものと考えています。部位特異的変異体などを用いて、さらに詳細な阻害様式を調べています。
分子シャペロンによるタンパク質の立体構造形成機構
ズブチリシンの成熟体領域のN末端側にはプロペプチドと呼ばれる領域があり、この部分を欠落させると活性を持ったズブチリシンが生成できないことから、プロペプチドはズブチリシン成熟体領域の立体構造形成(refolding)を補助する「分子内シャペロン」として働いていることがわかっています。またそれと同時に、ズブチリシンに阻害作用を示すことがわかっています。このようなユニークな性質を示すプロペプチドによるズブチリシンの立体構造形成補助作用について、さらに変異体を用いて解析を進めています。 上にも述べたPOIA1やYIB2は、このプロペプチドと低いながらも相同性を示します。このことから、POIA1もズブチリシンの立体構造形成を補助する「分子内シャペロン」として機能しうるか調べたところ、in vivoおよびin vitroの実験からPOIA1はそのような活性を持ち合わせていることがわかりました。現在、さらに様々な変異体を作成し、「プロテアーゼインヒビターによるプロテアーゼのrefolding」の分子機構について、詳細に解析を進めています。
αへリックス形成ペプチドによる繊維状集合体形成の分子機構
(LeuGluThrLeuAlaLysAla)3というアミノ酸配列を持つペプチドは安定なαヘリックスのみならず、電子顕微鏡で観察可能なほどの大きさの繊維状集合体を形成することを見出しました。現在、アルツハイマー病や狂牛病など、ペプチドあるいはタンパク質が「凝集」して、疾患を引き起こす例が知られています。これらの疾患の原因となっているペプチドやタンパク質は主に「βシート構造」を形成していることがわかりつつありますが、私たちが扱っているのはαへリックスからなる集合体です。そのような集合体を形成する分子機構やそれらの構造について研究を進め、βシート構造からなる集合体との違いなどを明らかにしようとしています。
活動実績
論文等発表
Takei, T., Tsumoto, K., Okonogi, A., Kimura, A., Kojima, S., Yazaki, K., Takei, T., Ueda, T. and Miura, K.
pH responsiveness of fibrous assemblies of repeat-sequence amphipathic α-helix polypeptide.
Protein Science 24, 883-894 (2015).
Tsuda, T., Asami, M., Koguchi, Y. and Kojima, S.
A single mutation alters the substrate specificity of L-amino acid ligase.
Biochemistry 53, 2650-2660 (2014).
Takei, T., Tsumoto, K., Yoshino, M., Kojima, S., Yazaki, K., Ueda, T., Takei, T., Arisaka, F. and Miura
Role of positions e and g in the fibrous assembly formation of an amphipathic α-helix-forming polypeptide.
Biopolymers (Peptide Science) 102, 260-272 (2014).
Takei, T., Hasegawa, K., Imada, K., Namba, K., Tsumoto, K., Kuriki, Y., Yoshino, M., Yazaki, K., Kojima, S., Takei, T., Ueda, T. and Miura, K.
Effects of chain length of an amphipathic polypeptide carrying the repeated amino acid sequence (LETLAKA)n on α-helix and fibrous assembly formation.
Biochemistry 52, 2810-2820 (2013)
Tsuda, T., Suzuki, T. and Kojima, S.
Crystallization and preliminary X-ray diffraction analysis of Bacillus subtilis YwfE, an L-amino-acid ligase.
Acta Crystal F68, 203-206 (2012).
Hemmi, H., Kumazaki, T., Kojima, S., Yoshida, T., Ohkubo, T., Yokosawa, H., Miura, K. and Kobayashi, Y.
Increasing the hydrolysis constant of the reactive site upon intrduction of an engineered Cys14-Cys35 bond into the ovomucoid third domain from silver pheasant.
J. Peptide Sci. 17, 595-600 (2011).
Shibata, N., Ueda, Y., Takeuchi, D., Haruyama, Y., Kojima, S. Sato, J., Niimura, Y., Kitamura, M. and Higuchi, Y.
Structure analysis of the flavoredoxin from Desufovibrio vulgaris Miyazaki F reveals key residues that discriminate the functions and properties of flavin reductase famiily.
FEBS. J , 276, 4840-4853 (2009).
Aoki, G., Yamada, T.K., Arii, M., Kojima, S. and Mizoguchi, T.
Requirement of Ala residues at g position in heptad sequence of α-helix-forming peptide for formation of fibrous structure.
J. Biochem. 144, 15-19 (2008).
Kojima, S., Iwahara, A., Hisano, Y. and Yanai, H.
Effects of hydrophobic amino acid substitution in Pleurotus ostreatus proteinase A inhibitor 1 on its structure and functions as protease inhibitor and intramolecular chaperone.
Protein Eng. Des. Sel. 20, 211-217 (2007).
プロフィール/メンバー
助教

中村 顕
京都大学理学部卒業
京都大学大学院理学研究科 研究指導認定退学(博士(理学))
経歴
2001年 京都大学理学部卒業
2006年 京都大学大学院理学研究科 研究指導認定退学(博士(理学))
2006~2010年 京都大学大学院理学研究科 博士研究員
2010~2016年 東京大学大学院農学生命科学研究科 特任助教
2016年~ 学習院大学理学部助教
学生
- D3 石田 航基 Ishida Kohki
- M2 久保田 里奈 Kubota Rina


