研究テーマ
脳老化とアルツハイマー病発症機構
超高齢社会を迎え加齢に伴う老化あるいはアルツハイマー病の予防/治療法開発は世界的に喫緊の研究テーマとなっています。老化した脳やアルツハイマー病患者脳では共通に神経原線維変化(Neurofibrillary tangle: NFT)と呼ばれる嗜銀性構造物が神経細胞内に観察されます。アルツハイマー病の脳ではNFTの他に老人斑と呼ばれ、βアミロイドが細胞の外に蓄積しているのが観察されます。家族性アルツハイマー病の原因遺伝子(APP, PSEN1, PSEN2)がβアミロイド産生に関係することから、βアミロイドが原因であるとする「βアミロイド仮説」に従ったアルツハイマー病治療薬開発が行われましたが、これまでに顕著な進行抑制効果は得られていません。
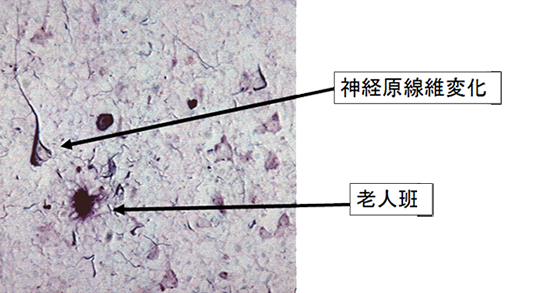
一方でNFTの分布や数は脳の萎縮程度や認知症の進行とよく相関することが知られています。NFTは過剰にリン酸化されたタウタンパク質が主な構成成分です。タウは微小管結合蛋白質で神経細胞では軸索に存在し微小管の安定化、軸索輸送に関係しています。当研究室ではNFTに注目してタウの生理的な機能、タウが神経細胞内で凝集する仕組み、凝集したタウが神経細胞死を起こす仕組みを調べて、世界中の研究者と共同で脳老化やアルツハイマー病発症機構を明らかにし、治療薬開発を行おうとしています。
タウタンパク質
タウタンパク質は微小管結合蛋白質で神経細胞では主に軸索に存在していますが、変性が起こる細胞ではリン酸化タウが樹状突起や細胞体に蓄積しているのが観察されます。
ヒトタウ遺伝子は17番染色体長腕17q21に存在し16個のエクソンから構成されています。タウタンパク質はエクソン2、エクソン2と3、及びエクソン10の選択的スプライシングによってアミノ酸が352−441個からなる分子量の異なる6種類のアイソフォームを発現しており、ヒトでは6種類のアイソフォームを発現しています。
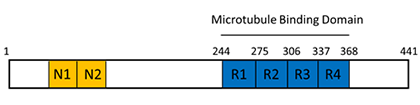
家族性認知症の一つである前頭側頭型認知症FTDP-17ではタウ遺伝子に変異が見出されています。変異はタウ遺伝子のエキソンとイントロンに存在しエキソンに存在する場合はアミノ酸置換が起こり、イントロンに存在する突然変異ではエキソン10の選択的スプライシングに関与しています。患者脳ではNFT、神経脱落が起こり認知症を引き起こしています。興味深いことにこの病気では老人斑は見出されていません。このことからアルツハイマー病で認知症を引き起こしているのはNFTと神経脱落であると考えることができます。当研究室ではFTDP-17変異タウの性質を調べ、どのようにしてタウが凝集し神経細胞死を引き起こすのかを調べています。
老化とアルツハイマー病の治療
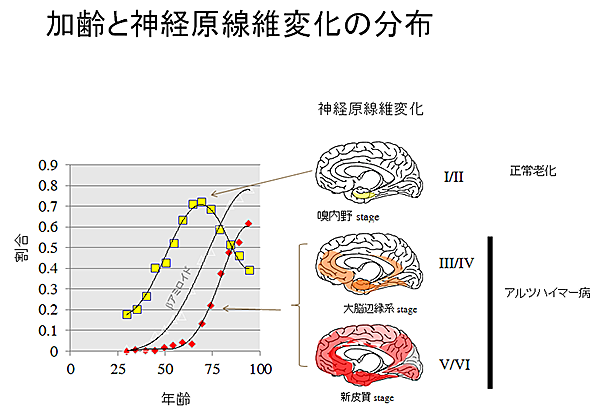
これまでの研究でNFTは加齢に伴って嗅内皮質と海馬(Braak stage I,II)に最初に出現し大脳辺縁系 (Braak stage III, IV)、さらに新皮質(Braak stage V, VI)へと広がります。嗅内野/海馬のNFTが観察される人では記憶機能、認知機能は正常の範囲に入りますが大脳辺縁系、新皮質に老人斑が出現した後NFTが観察されるようになりアルツハイマー病と診断される場合が多いです。嗅内野/海馬のNFTは老化によって引き起こされ、大脳辺縁系、新皮質では老人斑の下流でNFT形成が起こると考えられています。老人斑形成を阻害する化合物の臨床試験が行われましたが老人斑は消失しても認知症進行を抑制できませんでした。そこで当研究室ではNFT形成を阻害する化合物によって認知症治療を行う方法を探索しています。また、老化脳では嗅内野/海馬にNFTが形成されることから、これを指標にタウの生理機能と関連した脳老化研究を進めています。
活動実績
論文等発表
Polyunsaturated fatty acid deficiency during neurodevelopment in mice models the prodromal state of schizophrenia through epigenetic changes in nuclear receptor genes.
Maekawa M., Watanabe A., Iwayama Y., Kimura T., Hamazaki K., Balan S., Ohba H., Hisano Y., Nozaki Y., Ohnishi T., Toyoshima M., Shimamoto C., Iwamoto K., Bundo M., Osumi N., Takahashi E., Takashima A., Yoshikawa T.
Transl Psychiatry. 2017 Sep 5;7(9):e1229. doi: 10.1038/tp.2017.182. PubMed PMID: 28872641.
Mutation-induced loss of APP function causes GABAergic depletion in recessive familial Alzheimer's disease: analysis of Osaka mutation-knockin mice.
Umeda T., Kimura T., Yoshida K., Takao K., Fujita Y., Matsuyama S., Sakai A., Yamashita M., Yamashita Y., Ohnishi K., Suzuki M., Takuma H., Miyakawa T., Takashima A., Morita T., Mori H., Tomiyama T.
Acta Neuropathol Commun. 2017 Jul 31;5(1):59. doi: 10.1186/s40478-017-0461-5. PubMed PMID: 28760161; PubMed Central PMCID: PMC5537936.
Local somatodendritic translation and hyperphosphorylation of tau protein triggered by AMPA and NMDA receptor stimulation.
Kobayashi S., Tanaka T., Soeda Y., Almeida OF, Takashima A.
EBio Medicine. 2017 May 12. in press. doi: 10.1016/j.ebiom.2017.05.012.
Iso-α-acids, Bitter Components of Beer, Prevent Inflammation and Cognitive Decline Induced in a Mouse Model of Alzheimer's Disease.
Ano Y., Dohata A., Taniguchi Y., Hoshi A., Uchida K., Takashima A., Nakayama H.
J Biol Chem. 2017 Mar 3;292(9):3720-3728. doi: 10.1074/jbc.M116.763813. Epub 2017 Jan 13. PubMed PMID: 28087694; PubMed Central PMCID: PMC5339755.
Altered Tau Isoform Ratio Caused by Loss of FUS and SFPQ Function Leads to FTLD-like Phenotypes.
Ishigaki S., Fujioka Y., Okada Y., Riku Y., Udagawa T., Honda D., Yokoi S., Endo K.,Ikenaka K., Takagi S., Iguchi Y., Sahara N., Takashima A., Okano H., Yoshida M., Warita H., Aoki M., Watanabe H., Okado H., Katsuno M., Sobue G.
Cell Rep. 2017 Jan 31;18(5):1118-1131. doi: 10.1016/j.celrep.2017.01.013. PubMed PMID: 28147269.
Treatment of intermittent hypoxia increases phosphorylated tau in the hippocampus via biological processes common to aging.
Yagishita S., Suzuki S., Yoshikawa K., Iida K., Hirata A., Suzuki M., Takashima A., Maruyama K., Hirasawa A., Awaji T.
Mol Brain. 2017 Jan 5;10(1):2. doi: 10.1186/s13041-016-0282-7. PubMed PMID: 28057021; PubMed Central PMCID: PMC5217192.
Modification of Tau by 8-Nitroguanosine 3',5'-Cyclic Monophosphate(8-Nitro-cGMP): EFFECTS OF NITRIC OXIDE-LINKED CHEMICAL MODIFICATION ON TAU AGGREGATION.
Yoshitake J., Soeda Y., Ida T., Sumioka A., Yoshikawa M., Matsushita K., Akaike T., Takashima A.
J Biol Chem. 2016 Oct 21;291(43):22714-22720. Epub 2016 Sep 6. PubMed PMID: 27601475; PubMed Central PMCID: PMC5077206. doi: 10.1074/jbc.M116.734350.
Mechanism of neurodegeneration through tau and therapy for Alzheimer disease. Journal of Sport and Health Science.
Takashima A.
2016. doi: 10.1016/j.jshs.2016.08.009.
Bexarotene targets autophagy and is protective against thromboembolic stroke in aged mice with tauopathy.
Huuskonen MT., Loppi S., Dhungana H., Keksa-Goldsteine V., Lemarchant S., Korhonen P., Wojciechowski S., Pollari E., Valonen P., Koponen J., Takashima A., Landreth G., Goldsteins G., Malm T., Koistinaho J., Kanninen KM.
Sci Rep. 2016 Sep 14;6:33176. doi: 10.1038/srep33176.
Toxic tau oligomer formation blocked by capping of cysteine residues with 1,2-dihydroxybenzene groups.
Soeda Y.,Yoshikawa M., Almeida OF., Sumioka A., Maeda S., Osada H., Kondoh Y., Saito A., Miyasaka T., Kimura T., Suzuki M., Koyama H., Yoshiike Y., Sugimoto H., Ihara Y., Takashima A.
Nat Commun. 2015 Dec 16;6:10216. doi: 10.1038/comms10216.
Glycogen Synthase Kinase-3β-mediated Phosphorylation in the Most C-terminal Region of Protein Interacting with C Kinase 1 (PICK1) Regulates the Binding of PICK1 to Glutamate Receptor Subunit GluA2.
Yagishita S., Murayama M., Ebihara T., Maruyama K., Takashima A.
J Biol Chem. 2015 Dec 4;290(49):29438-48. doi: 10.1074/jbc.M114.619668.
I2020T mutant LRRK2 iPSC-derived neurons in the Sagamihara family exhibit increased Tau phosphorylation through the AKT/GSK-3β signaling pathway.
Ohta E., Nihira T., Uchino A., Imaizumi Y., Okada Y., Akamatsu W., Takahashi K., Hayakawa H., Nagai M., Ohyama M., Ryo M., Ogino M., Murayama S., Takashima A., Nishiyama K., Mizuno Y., Mochizuki H., Obata F., Okano H.
Hum Mol Genet. 2015 Sep 1;24(17):4879-900. doi: 10.1093/hmg/ddv212.
Female Hippocampus Vulnerability to Environmental Stress as Precipitating Factor in Tau Aggregation Pathology.
Sotiropoulos I., Silva J., Kimura T., Rodrigues AJ., Costa P., Almeida OF., Sosa N., Takashima A.
J Alzheimers Dis. 2015 Jan 1;43(3):763-74. doi: 10.3233/JAD-140693.
Neurofibrillary tangle formation by introducing wild-type human tau into APP transgenic mice.
Umeda T., Maekawa S., Kimura T., Takashima A., Tomiyama T., Mori H.
Acta Neuropathol. 2014 May; 127(5):685-98. doi:10.1007/s00401-014-1259-1. Epub 2014 Feb 15. PMID: 24531886.
Biochemical Distribution of Tau Protein in Synaptosomal Fraction of Transgenic Mice Expressing Human P301L Tau.
Sahara N., Murayama M., Higuchi M., Suhara T., Takashima A.
Front Neurol. 2014 Mar 11;5:26. doi: 10.3389/fneur.2014.00026. eCollection 2014. PMID: 24653715.
Microtubule-associated protein tau is essential for long-term depression in the hippocampus.
Kimura T., Whitcomb DJ., Jo J., Regan P., Piers T., Heo S., Brown C., Hashikawa T., Murayama M., Seok H., Sotiropoulos I., Kim E., Collingridge GL., Takashima A., and Cho K.
Philos Trans R Soc Lond B Biol Sci. 2013 Dec 2;369(1633):20130144. doi: 10.1098/rstb.2013.0144. Print 2014 Jan 5. PMID: 24298146.
Acceleration of bone development and regeneration through the Wnt/β-catenin signaling pathway in mice heterozygously deficient for GSK-3β.
Arioka M., Takahashi-Yanaga F., Sasaki M., Yoshihara T., Morimoto S., Takashima A., Mori Y., Sasaguri T.
Biochem Biophys Res Commun. 2013 Nov 1;440(4):677-82. doi: 10.1016/j.bbrc.2013.09.126. Epub 2013 Oct 4. PMID: 24099767.
Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls.
Maruyama M., Shimada H., Suhara T., Shinotoh H., Ji B., Maeda J., Zhang MR., Trojanowski JQ., Lee VM. Ono M., Masamoto K., Takano H., Sahara N., Iwata N., Okamura N., Furumoto S., Kudo Y., Chang Q., Saido TC., Takashima A., Lewis J., Jang MK., Aoki I., Ito H., Higuchi M.
Neuron. 2013 Sep 18;79(6):1094-108. doi: 10.1016/j.neuron.2013.07.037. PMID: 24050400.
Neurodegenerative disorder FTDP-17-related tau intron 10 +16C → T mutation increases tau exon 10 splicing and causes tauopathy in transgenic mice.
Umeda T, Yamashita T, Kimura T, Ohnishi K, Takuma H, Ozeki T, Takashima A, Tomiyama T, Mori H.
Am J Pathol. 2013 Jul;183(1):211-25. doi: 10.1016/j.ajpath.2013.03.015. Epub 2013 May 13. PMID: 23680655.
Phenolic compounds prevent amyloid β-protein oligomerization and synaptic dysfunction by site-specific binding.
Ono K., Li L., Takamura Y., Yoshiike Y., Zhu L., Han F., Mao X., Ikeda T., Takasaki J., Nishijo H., Takashima A., Teplow DB., Zagorski MG., Yamada M.
J Biol Chem. 2012 Apr 27;287(18):14631-43. doi: 10.1074/jbc.M111.325456. Epub 2012 Mar 5.PMID: 22393064.
Adaptive responses to alloxan-induced mild oxidative stress ameliorate certain tauopathy phenotypes.
Yoshiike Y., Yamashita S., Mizoroki T., Maeda S., Murayama M., Kimura T., Sahara N., Soeda Y., Takashima A.
Aging Cell. 2012 Feb; 11(1):51-62. doi: 10.1111/j.1474-9726.2011.00756.x. Epub 2011 Nov 15.
Binding of curcumin to senile plaques and cerebral amyloid angiopathy in the aged brain of various animals and to neurofibrillary tangles in Alzheimer's brain.
Mutsuga M., Chambers JK., Uchida K., Tei M., Makibuchi T., Mizorogi T., Takashima A., Nakayama H.
J Vet Med Sci. 2012 Jan;74(1):51-7. Epub 2011 Sep 2.
Regulation of Physiologic Actions of LRRK2:Focus on Autophagy.
Ferree A., Guillily M., Li H., Smith K., Takashima A., Squillace R., Weigele M., Collins JJ., Wolozin B.
Neurodegener Dis. 2012;10(1-4):238-41. doi:10.1159/000332599. Epub 2011 Dec 23.
Central nervous system-specific deletion of transcription factor Nrf1 causes progressive motor neuronal dysfunction.
Kobayashi A., Tsukide T., Miyasaka T., Morita T., Mizoroki T., Saito Y., Ihara Y., Takashima A., Noguchi N., Fukamizu A., Hirotsu Y., Ohtsuji M., Katsuoka F., Yamamoto M.
Genes Cells. 2011 Jun;16(6):692-703. doi: 10.1111/j.1365-2443.2011.01522.x. Epub 2011 May 10.
Differential regional distribution of phosphorylated tau and synapse loss in the nucleus accumbens in tauopathy model mice.
Kambe T., Motoi Y., Inoue R., Kojima N., Tada N., Kimura T., Sahara N., Yamashita S., Mizoroki T., Takashima A., Shimada K., Ishiguro K., Mizuma H., Onoe H., Mizuno Y., Hattori N.
Neurobiol Dis. 2011 Jun;42(3):404-14. doi: 10.1016/j.nbd.2011.02.002. Epub 2011 Feb 13.
プロフィール/メンバー
教授

髙島 明彦
九州大学理学部生物学科卒業
九州大学大学院理学研究科生物学専攻修士課程 修了
教授経歴
1979年 九州大学理学部生物学科卒業
1981年 九州大学大学院理学研究科生物学専攻修士課程 修了
1981~1987年 佐賀医科大学
1987年 理学博士(九州大学)
1987~1991年 米国国立衛生研究所 客員研究員
1991~1993年 三菱化学生命科学研究所 特別研究員
1993~1998年 三菱化学生命科学研究所 主任研究員
1998~2011年 理化学研究所アルツハイマー病研究チーム チームリーダー
2000~2004年 東京工業大学生命理工学部 客員教授
2011~2016年
長寿医療研究センター 分子基盤研究部 部長
2016年~ 学習院大学理学部教授
(生命科学科、生命分子科学研究所)
助教
添田 義行
東北薬科大学薬学部卒業
薬学博士(富山大学)
学生
- D1 小池 力 Riki Koike
- M2 山下 真央 Mao Yamasita
- M2 横尾 遥 Haruka Yoko
- M1 近江 咲子 Omi Sakiko
- M1 長谷川 湧人 Hasegawa Yuto
- B4 北原 渚生 Kitahara sho
- B4 古賀 唯斗 Koga Yuito
- B4 上村 浩太 Uemura Kota
- B4 角道 友香 Kakudo Yuka
- B4 青木 美沙子 Aoki Misako
- B4 林 達也 Hayashi Tatsuya
- B4 森田 文也 Morita Fumiya


