【研究成果】タンパク質分解酵素に対する短いペプチド性阻害剤の開発
2022.10.06
タンパク質分解酵素に対する短いペプチド性阻害剤の開発
Development of a novel peptide inhibitor of subtilisin BPN′
1.発表者
| 石田 航基 | : | 学習院大学大学院自然科学研究科生命科学専攻・博士後期課程3年 |
| 清水 誠 | : | 学習院大学大学院自然科学研究科化学専攻・修了生 |
| 若杉 歩 | : | 学習院大学理学部化学科・卒業生 |
| 松井 悠子 | : | 学習院大学理学部生命科学科・卒業生 |
| 中村 顕 | : | 学習院大学理学部生命科学科・助教 |
| 小島 修一 | : | 学習院大学理学部生命科学科・教授(当時) |
2.ポイント
- ファージディスプレイ法(※)を用いて、代表的なタンパク質分解酵素であるSubtilisin BPN′に結合するペプチド(※)を探索しました。
- 見出された12残基からなるペプチドがSubtilisin BPN′の酵素活性を阻害することを明らかにしました。
- 阻害活性にはペプチド分子内で形成されているジスルフィド結合が必要不可欠であることが分かりました。
- ペプチドのアミノ酸変異により、これまでに知られているペプチド性阻害剤で最も高い阻害活性を持つ阻害ペプチドを開発しました。
3.概要
タンパク質分解酵素に対する効果的な阻害剤の開発は創薬や基礎研究において重要です。現在までに、自然界の生物から抽出されたものや有機合成したもの、分子サイズの小さいものからタンパク質のように大きいものなど、様々な酵素阻害剤が知られていますが、本研究では、低分子の安定性と高分子の特異性・高親和性を合わせもつと期待されるペプチド性の酵素阻害剤に注目しました。まず、代表的なタンパク質分解酵素(※)であるSubtilisin BPN′を標的として、その新たな阻害剤の候補となるペプチドをファージディスプレイ法によって探索しました。次に、このペプチドがタンパク質分解酵素を阻害する活性を持つことを確認しました。このようにして得たペプチドを基にして、長さを短くしたり、ペプチドを構成するアミノ酸を別のアミノ酸に置き換えたりすることによって、さらに高い阻害活性を持つペプチドを見出しました。最終的に得られたペプチドは、これまでに知られている天然アミノ酸からなるペプチド性のSubtilisin BPN′阻害剤で最も短く、最も阻害活性が高いものとなりました(図1)。
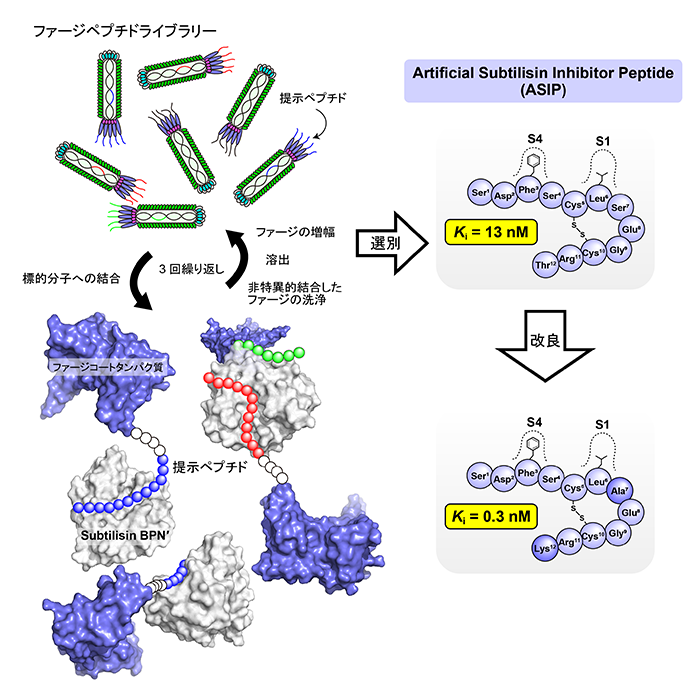
図1.ファージディスプレイ法によるSubtilisin BPN′に結合するペプチドの選別とその改良
本研究成果は、2022年9月22日にFEBS Open Bio誌のオンライン版に掲載されました。また、本発表は、学習院大学グランドデザイン 2039「国際学術誌論文掲載補助事業」より掲載費を助成しています。
4.内容
<研究の背景>
医薬品開発では、標的となる疾患関連タンパク質に相互作用する物質として、分子量が数百程度の低分子から分子量が数万にもなるタンパク質などの高分子に至る幅広い分子種が研究対象となります。例えば、新型コロナウイルス感染症に関する医薬品では、原因となるSARS-CoV-2に由来するタンパク質と相互作用し、そのはたらきを抑制するための低分子薬剤やタンパク質分子である抗体が利用されています。タンパク質性の薬剤は標的分子との間の相互作用が比較的強く、また特異性が高いという特徴がありますが、その分子サイズの大きさと安定性の問題から生産性が低いという課題があります。一方で、標的に合わせた様々な官能基を持つ低分子薬剤は合成が容易で、特異性を高めることも可能ですが、分子サイズの小ささから標的分子との相互作用はタンパク質性の薬剤と比較して低くなってしまいます。そこで、中間の分子サイズとなり(中分子とも呼ばれ)、低分子・高分子の両方の利点を備えることが期待されるペプチドも注目されています。本研究では、タンパク質分解酵素の代表格であるSubtilisin BPN′(ズブチリシン ビーピーエム プライム)を標的として、この分子に結合し高い酵素阻害活性を持つペプチドを開発することとしました。
<研究成果>
はじめに、ファージディスプレイ法を用いて、アミノ酸12残基で構成され、様々な配列をもつペプチドライブラリーの中から、Subtilisin BPN′に強く結合するペプチドを選別しました。選別され、アミノ酸配列を決定した16種類のペプチドのうち、7種類が同一の配列を持つことが明らかとなり、この配列を持つペプチドが優先的にSubtilisin BPN′に結合することが分かりました。このペプチドはSubtilisin BPN′に対する阻害活性を持つことが期待されたため、人工的ズブチリシン阻害ペプチド(Artificial Subtilisin Inhibitor Peptide: ASIP)と名付けました。
化学合成したASIPを用いてSubtilisin BPN′に対する阻害活性を調べると、還元的条件下ではSubtilisin BPN′に対する阻害活性を示さず、アミノ末端から6番目のロイシン残基(Leu6)と7番目のセリン残基(Ser7)の間で切断されてしまうことが分かりました。一方、酸化的条件下ではKi=13.0 nM(※)の阻害活性を示すことが明らかとなりました。酸化的条件下では、ペプチド中のアミノ末端から5番目と10番目のシステイン残基の間に分子内ジスルフィド結合が形成されており(Cys5-Cys10)、このことがASIPの酵素阻害活性にとって重要であることが分かりました。
つづいて、ASIPにおいて阻害活性に必要不可欠な範囲を調べるために、ASIPを両端から1残基ずつ削ったペプチドを調製し、Subtilisin BPN′に対する阻害活性を測定しました。アミノ末端から1残基削除しても阻害活性はほとんど変化しなかった一方で、アミノ末端から2残基削除すると23%、カルボキシ末端から1残基削除すると12%、2残基削除すると66%の阻害活性の低下がみられました。すなわち、ASIPとSubtilisin BPN′との結合にはASIPのカルボキシ末端側の寄与が大きいことが示唆されます。また、アミノ末端から3残基削除したり、両端から2残基ずつ削除したりすると、阻害活性がほぼ失われることも分かりました。特に3番目のフェニルアラニン残基(Phe3)についてはSubtilisin BPN′に存在する「かさ高い」アミノ酸に対応した結合ポケットとの相互作用が予想されるため、Phe3が失われることで、ASIPがSubtilisin BPN′に強く結合できなくなると考えられます。
また、ASIPを構成するアミノ酸残基を1つずつアラニン残基に置き換えた(アラニン変異させた)実験を行ったところ、アミノ末端から1番目のセリン残基(Ser1)の変異では阻害活性にほとんど影響がなかった一方で、2番目のアスパラギン酸残基(Asp2)や11番目のアルギニン残基(Arg11)では、前述のアミノ末端あるいはカルボキシ末端から2残基削除した場合と同じような阻害活性の低下がみられました。このほか、アミノ末端から3番目のフェニルアラニン残基(Phe3)、6番目のロイシン残基(Leu6)、8番目のグルタミン酸残基(Glu8)のアラニン変異において阻害活性の低下がみられました。これらのアミノ酸残基におけるアラニン変異はSubtilisin BPN′への結合力の低下をもたらすためと予想されます。対照的に、アミノ末端から7番目のセリン残基(Ser7)と12番目のスレオニン残基(Thr12)におけるアラニン変異では、阻害活性が上昇することが分かりました。そこで、この二つのアミノ酸残基を様々なアミノ酸残基に置換して阻害活性を測定したところ、Ser7をアラニン残基に、Thr12をリシン残基にする変異を組み合わせた場合に、最も強い阻害活性を示すペプチドとなることが分かりました(Ki=0.30 nM)。
ASIPのアミノ酸配列を他のSubtilisin BPN′阻害剤のものと比較すると、ASIPが強い酵素阻害活性を持つ理由を推定することができます。タンパク質分解酵素によって切断をうける基質ペプチド(タンパク質)では、切断されるペプチド結合のアミノ末端側のアミノ酸残基の位置はP1、そこからアミノ末端側へP2、P3、・・・と呼ばれます。また、切断されるペプチド結合のカルボキシ末端側のアミノ酸残基の位置はP1′、さらにカルボキシ末端側へ向かってP2′、P3、・・・′と呼ばれます。一方で、Subtilisin BPN′には基質ペプチド(タンパク質)の切断部位周辺のアミノ酸残基ごとに結合させる場所が設けられており、P1位置に対応する場所がS1、P1′位置に対応する場所はS1′と呼ばれます(図2)。既に報告されているペプチド性あるいはタンパク質性のSubtilisin BPN′阻害剤について、位置ごとにアミノ酸を並べて比較すると共通点やASIPの特徴が分かります。例えば、P1位置には疎水性を示すアミノ酸残基が存在することが多く、これはSubtilisin BPN′のS1ポケットが疎水性を示す官能基を受容しやすい構造を持っているからです。また、ASIP以外ではP2位置のアミノ酸残基とP1′位置のアミノ酸残基の間で水素結合ネットワークが形成され、P1部位周辺の構造を固くすることで酵素によってペプチド結合が切断されないようになっていると考えられていますが、ASIPではP2位置とP4′位置のアミノ酸残基間で分子内ジスルフィド結合を形成することで同じような切断耐性を獲得しているものと考えられます。また、ASIPがP1とP1′の間で切断されてしまっても、分子内ジスルフィド結合のおかげでバラバラにならずにSubtilisin BPN′の基質結合部位に留まることによって、阻害能を発揮しているとも考えられます。このほか、ASIPではP4位置のかさ高いアミノ酸残基やP6′位置の塩基性アミノ酸残基がSubtilisin BPN′との相互作用に大きく寄与していることが示唆されました。
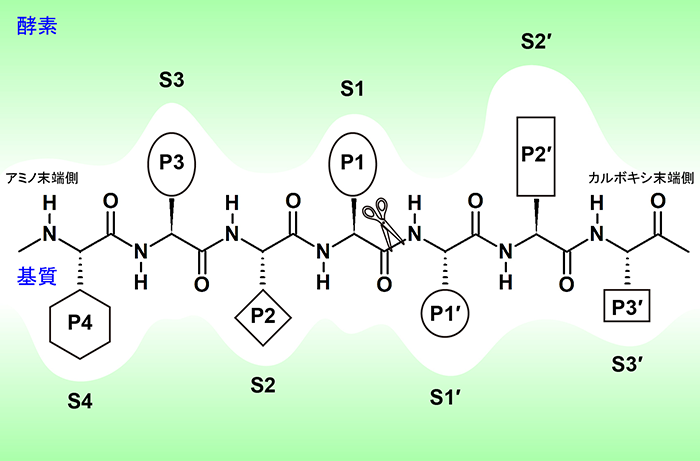
図2.ペプチド結合切断部位周辺の酵素-基質結合の模式図
<今後の展開>
現在、本研究で開発したSubtilisin BPN′に対する新規ペプチド性阻害剤がどのようにタンパク質分解酵素のはたらきを阻害するのかを明らかにするため、両者が結合した状態での立体構造解析に取り組んでいます。これにより、このペプチドによる新しい酵素阻害メカニズムに関する知見が得られると考えています。また、このようにして明らかにした酵素-阻害剤の相互作用様式をもとに、さらに強力で安定な新たな阻害剤の開発へと繋がることが期待されます。
【用語解説】
| ペプチド | : |
複数のアミノ酸がペプチド結合(アミド結合)により直鎖状に繋がった分子。構成するアミノ酸の化学構造から、アミノ末端とカルボキシ末端を持つ。アミノ酸50~100個程度までの分子がペプチドと呼ばれ、より長くアミノ酸が繋がった分子はタンパク質と呼ばれることが多い。 |
| タンパク質分解酵素 | : |
タンパク質をペプチドあるいはアミノ酸に分解する酵素でプロテアーゼと呼ばれる。活性部位の特徴から、セリンプロテアーゼ、システインプロテアーゼ、メタロ(金属)プロテアーゼなどの種類がある。 |
| ファージディスプレイ法 | : |
細菌に感染するウイルスであるバクテリオファージの表面にペプチドを提示させ、様々なペプチド配列を提示させたファージから標的分子に結合するファージ、すなわち標的分子と相互作用するペプチドを表面に提示したファージを選択する方法。George Pearson Smith博士が1985年に開発した手法で、同氏は2018年のノーベル化学賞を受賞した。 |
| Ki | : |
阻害定数と呼ばれ、酵素と阻害剤の解離定数を表す。値が小さいほど、酵素に対する阻害剤の親和性が高い。 |
(論文情報)
著者名:Kohki Ishida, Makoto Shimizu, Ayumi Wakasugi, Yuko Matsui, Akira Nakamura, Shuichi Kojima
論文名:Development of a novel peptide inhibitor of subtilisin BPN′
雑誌名:FEBS Open Bio
DOI :10.1002/2211-5463.13481
URL :https://febs.onlinelibrary.wiley.com/doi/10.1002/2211-5463.13481







