プレスリリース
-
2025.12.24
【研究成果・プレスリリース】高伝導金属における異常ホール効果を理解する理論を提唱 -電子の量子位相干渉と磁気相関の協奏効果を理論的に解明-
-

2025.12.23
【プレスリリース】学習院大学とキャンパスクリエイトの産学連携協定により実用化へ前進 -学習院大学・稲熊教授の研究成果、 中島産業がサブライセンスを取得-
-
2025.12.03
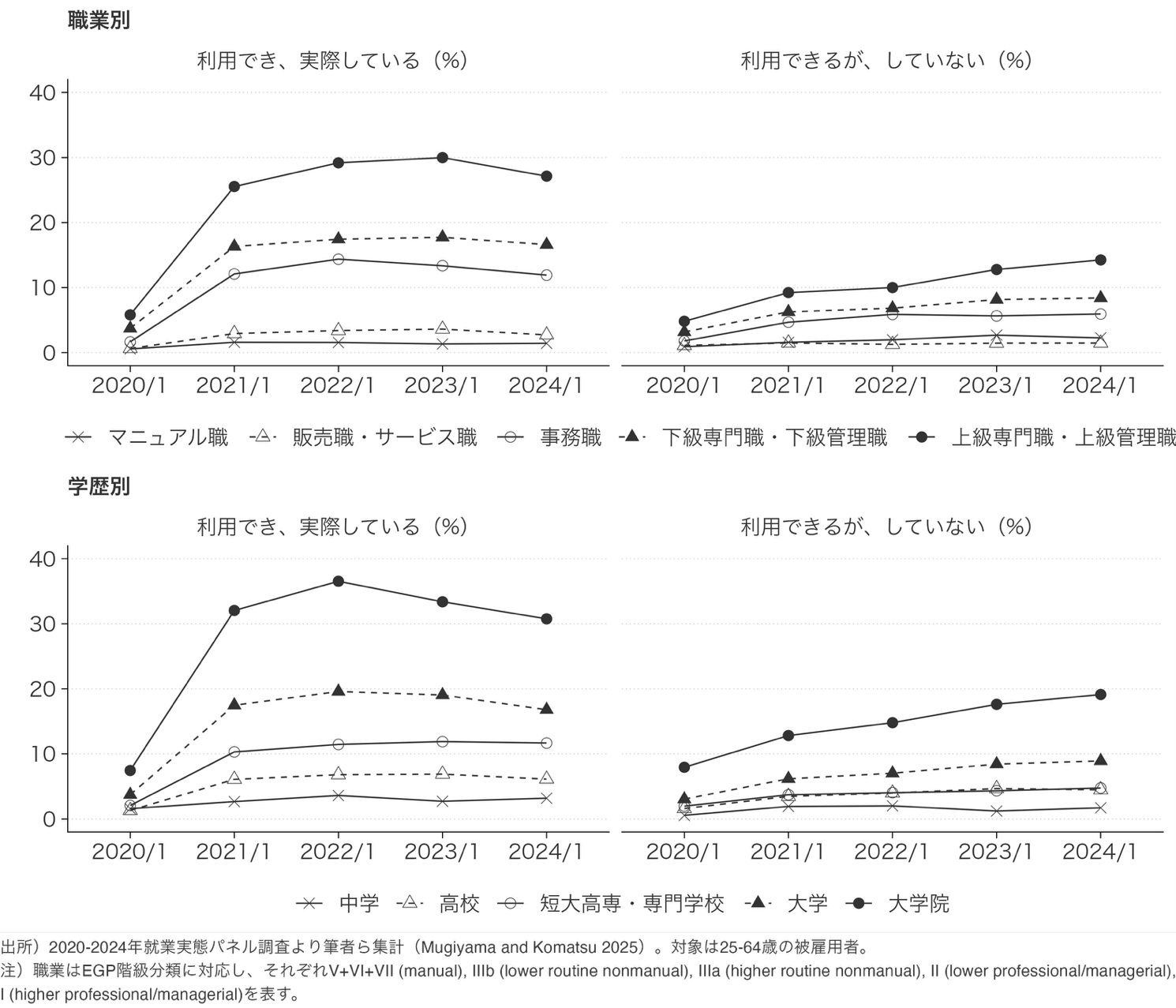
【研究成果・プレスリリース】コロナ禍で広がったテレワークの「選択肢」の格差 2020-2024年の継続調査を用いて制度の普及率が職業と学歴によって異なることを実証
-

2025.10.20
【研究成果】進化の頂点or袋小路?:ミズギワカメムシのオス附属腺
-

2025.09.11
【研究成果・プレスリリース】海外市場において自社の強みを再定義する戦略 リソース・リポジショニング・フレームワークの開発 イオン、イオンモールの海外進出ケースを分析
-
2025.09.11
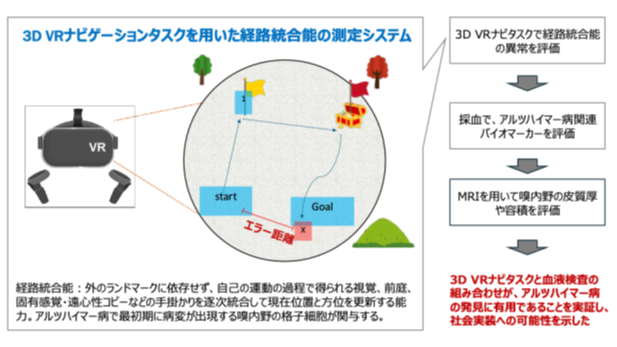
【研究成果・共同プレスリリース】3D仮想現実ナビゲーションでアルツハイマー病の超早期変化を発見 ― 血液アルツハイマー病指標と組み合わせたスクリーニングの有用性を実証―
-
2025.08.26
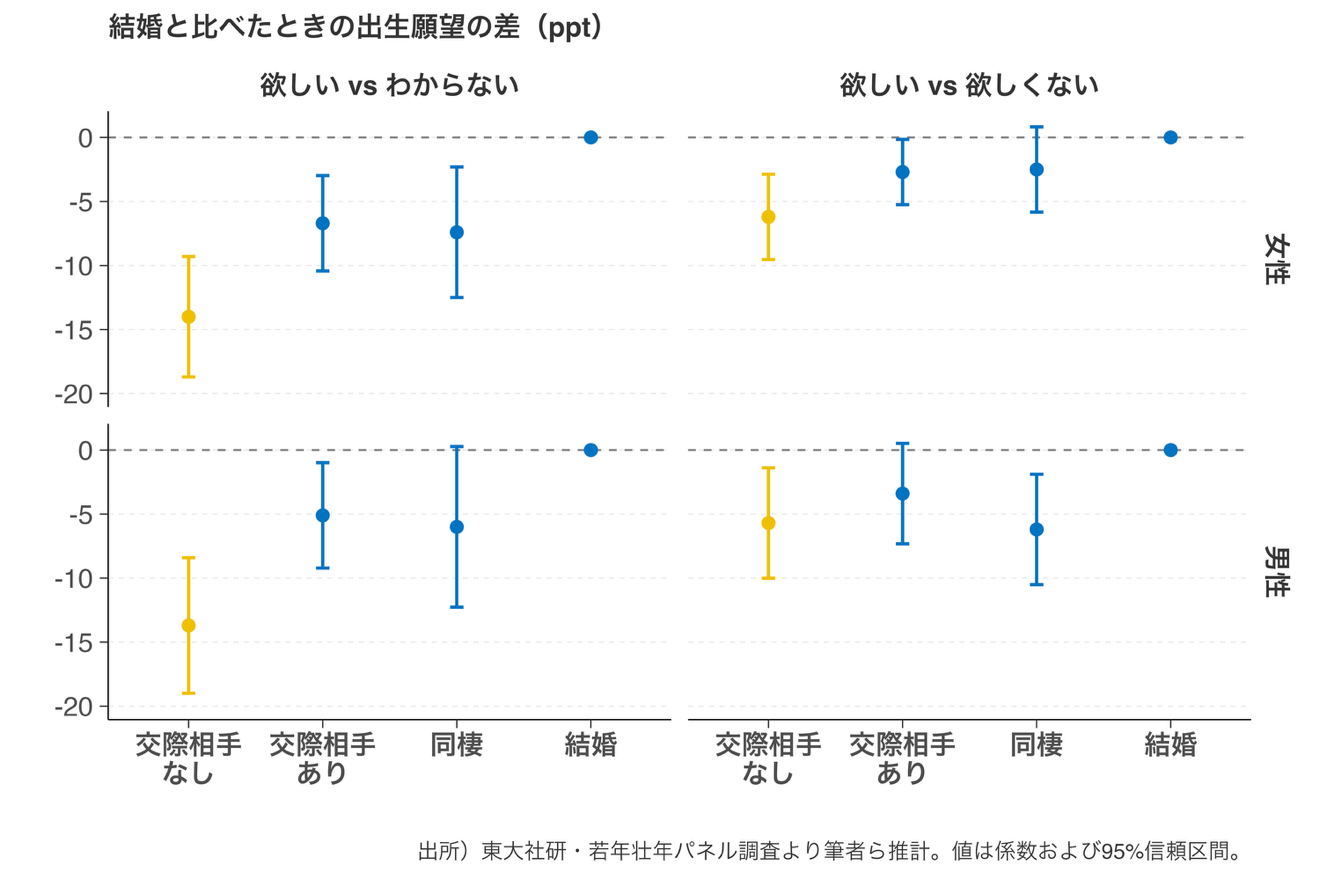
【研究成果・プレスリリース】交際相手がいないと「子どもが欲しい」が不確実に 恋愛関係が出生願望に与える影響をパネルデータで実証
-

2025.08.08
【研究成果・プレスリリース】日本とアメリカにおいて政治家の政策的主張の説得力が政治家の性別によって異ならないことを実証
-
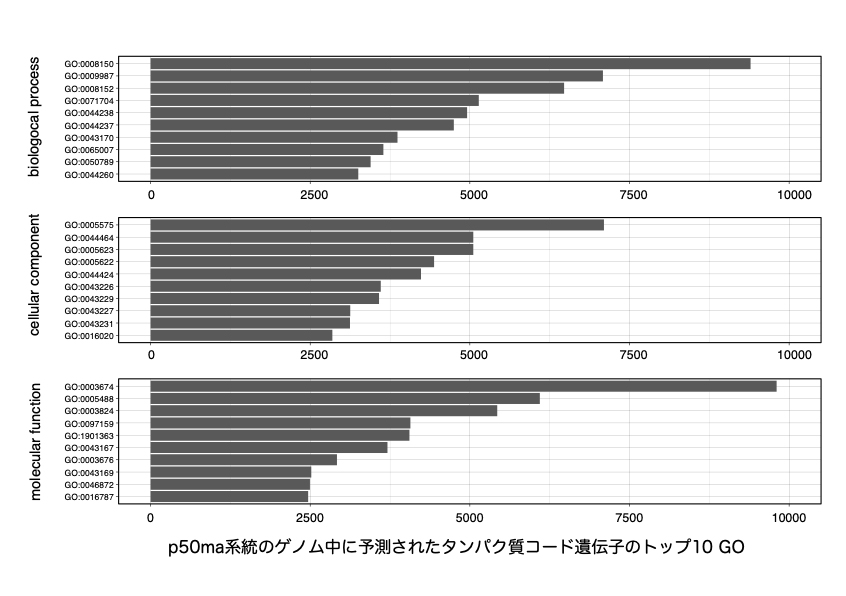
2025.03.31
【研究成果・プレスリリース】カイコの新しい標準系統であるp50ma系統の高精度ゲノムアノテーション情報を公開
-

2025.03.26
【プレスリリース】学習院大学と日本女子大学との共同研究成果から誕生した「マイトルビン入浴剤」を使用したイベントを都内29か所の銭湯で開催―学習院大学発ベンチャー企業の株式会社マイトジェニックが入浴剤を製作
-

2025.03.03
【研究成果・プレスリリース】日本における買収防衛策の特異な発展
-
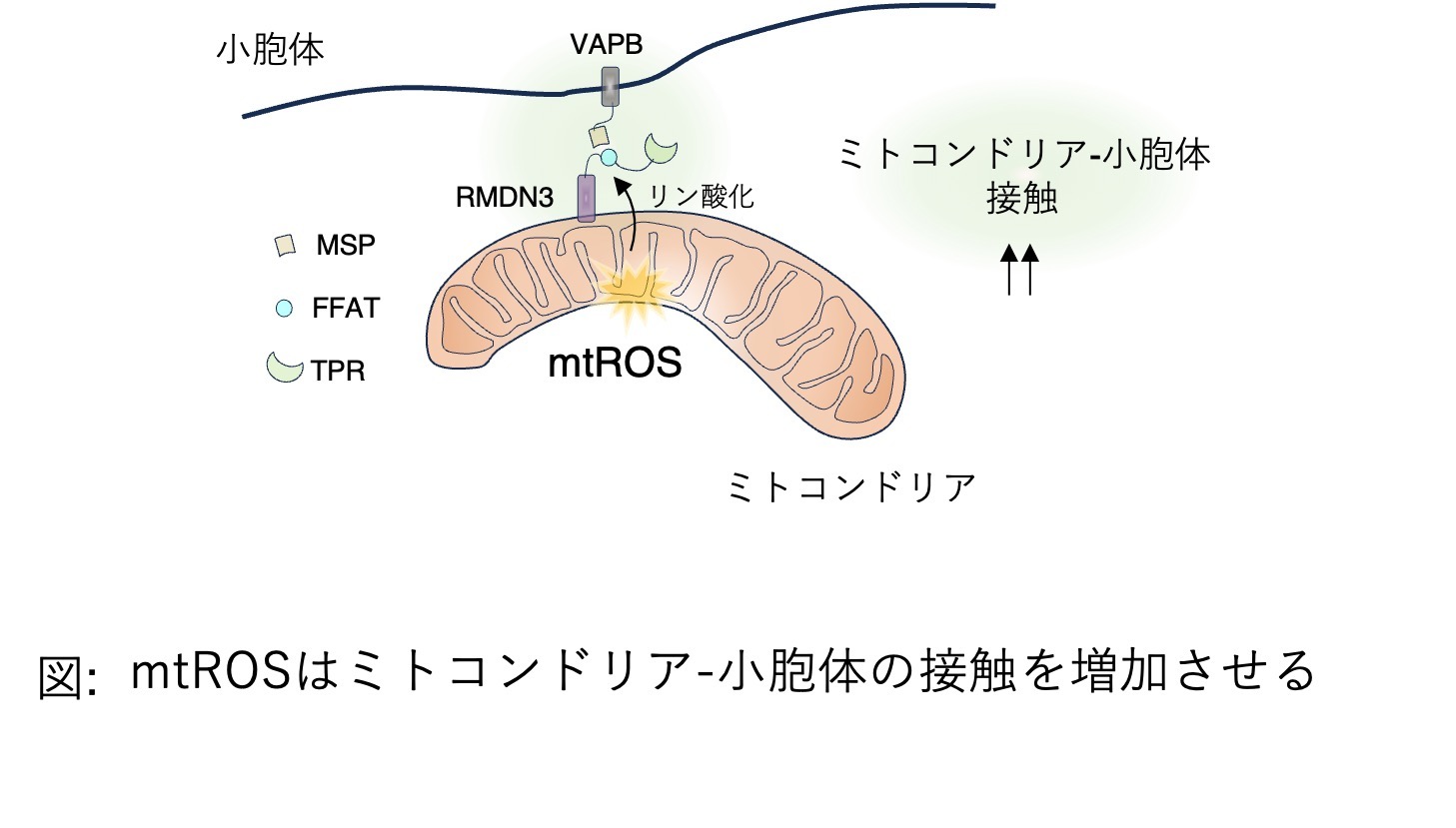
2025.02.14
【研究成果・プレスリリース】ミトコンドリアのストレス対策メカニズムを解明! 細胞の健康を守る仕組みを発見






