プレスリリース
-

2025.09.11
【研究成果・プレスリリース】海外市場において自社の強みを再定義する戦略 リソース・リポジショニング・フレームワークの開発 イオン、イオンモールの海外進出ケースを分析
-
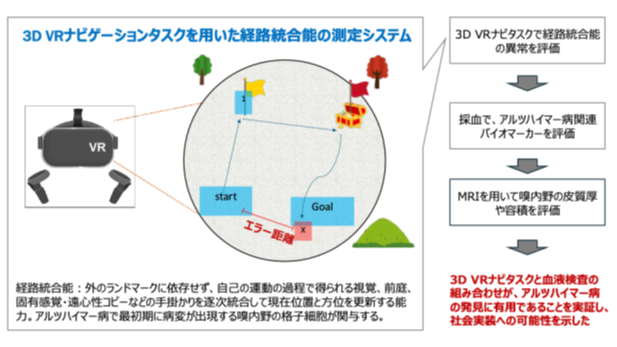
2025.09.11
【研究成果・共同プレスリリース】3D仮想現実ナビゲーションでアルツハイマー病の超早期変化を発見 ― 血液アルツハイマー病指標と組み合わせたスクリーニングの有用性を実証―
-
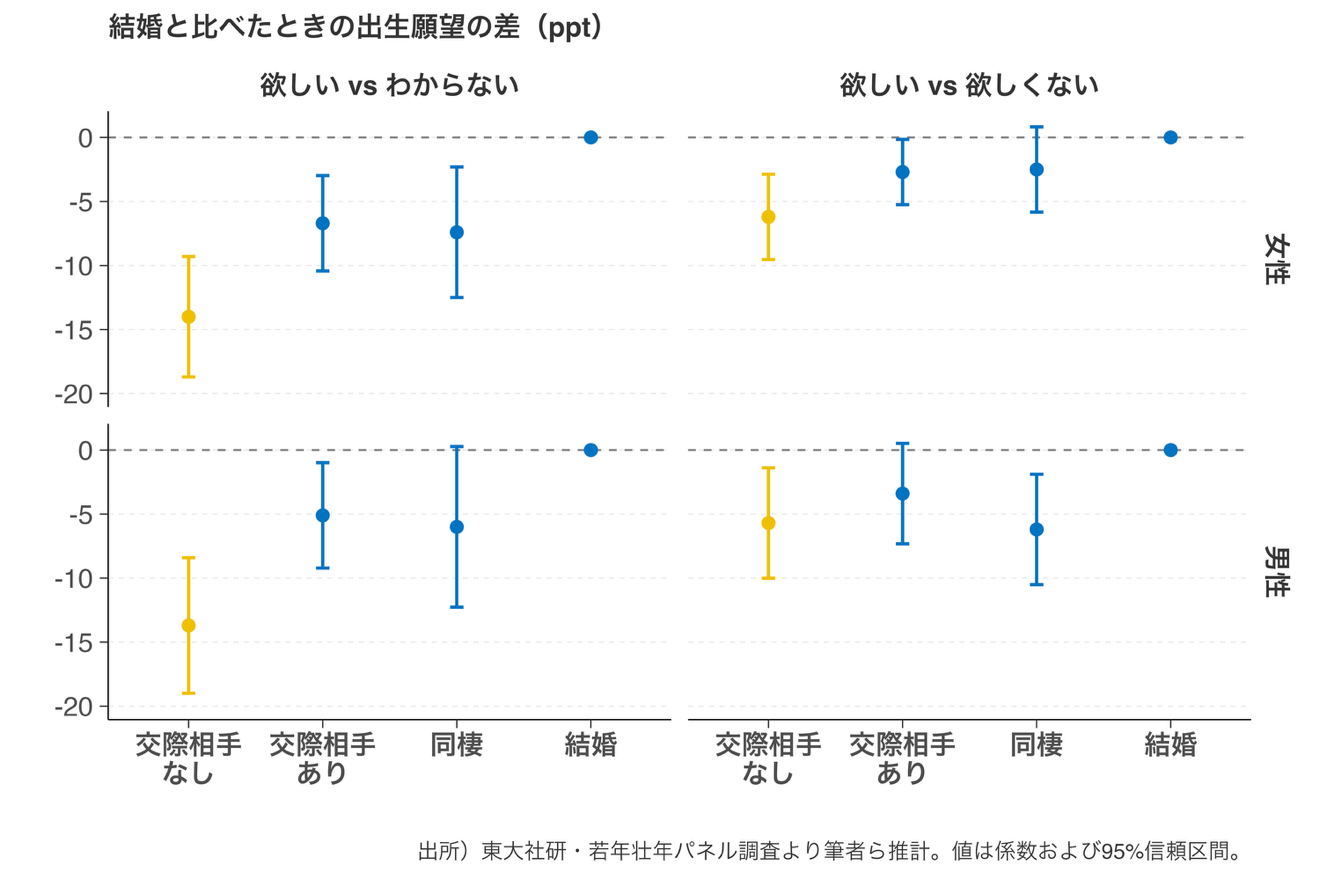
2025.08.26
【研究成果・プレスリリース】交際相手がいないと「子どもが欲しい」が不確実に 恋愛関係が出生願望に与える影響をパネルデータで実証
-

2025.08.08
【研究成果・プレスリリース】日本とアメリカにおいて政治家の政策的主張の説得力が政治家の性別によって異ならないことを実証
-
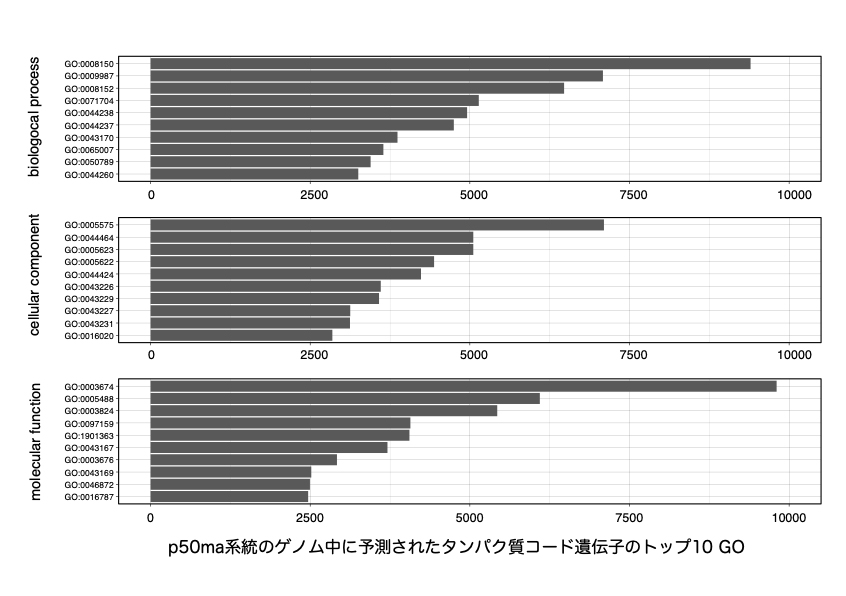
2025.03.31
【研究成果・プレスリリース】カイコの新しい標準系統であるp50ma系統の高精度ゲノムアノテーション情報を公開
-

2025.03.26
【プレスリリース】学習院大学と日本女子大学との共同研究成果から誕生した「マイトルビン入浴剤」を使用したイベントを都内29か所の銭湯で開催―学習院大学発ベンチャー企業の株式会社マイトジェニックが入浴剤を製作
-

2025.03.03
【研究成果・プレスリリース】日本における買収防衛策の特異な発展
-
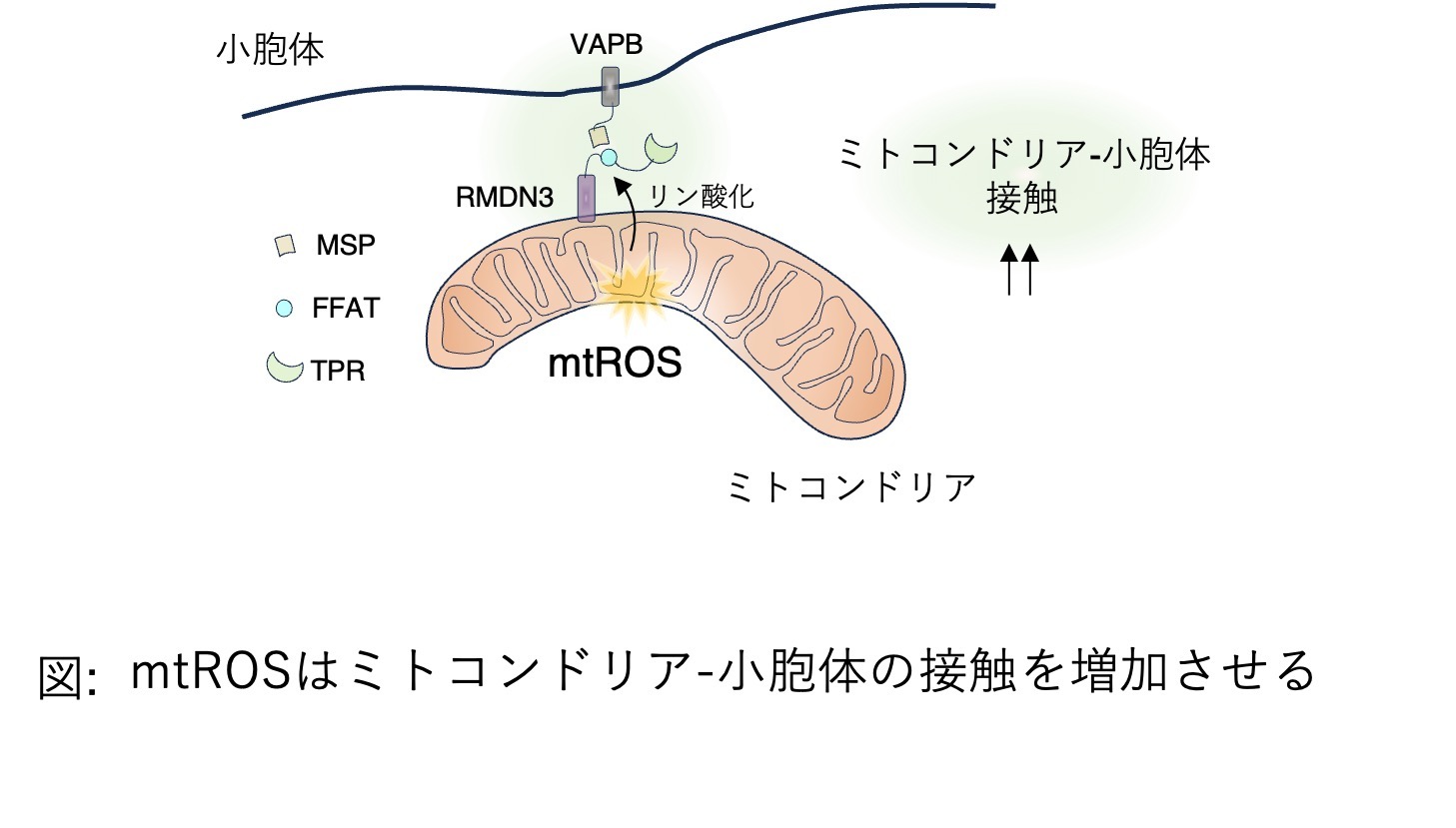
2025.02.14
【研究成果・プレスリリース】ミトコンドリアのストレス対策メカニズムを解明! 細胞の健康を守る仕組みを発見
-
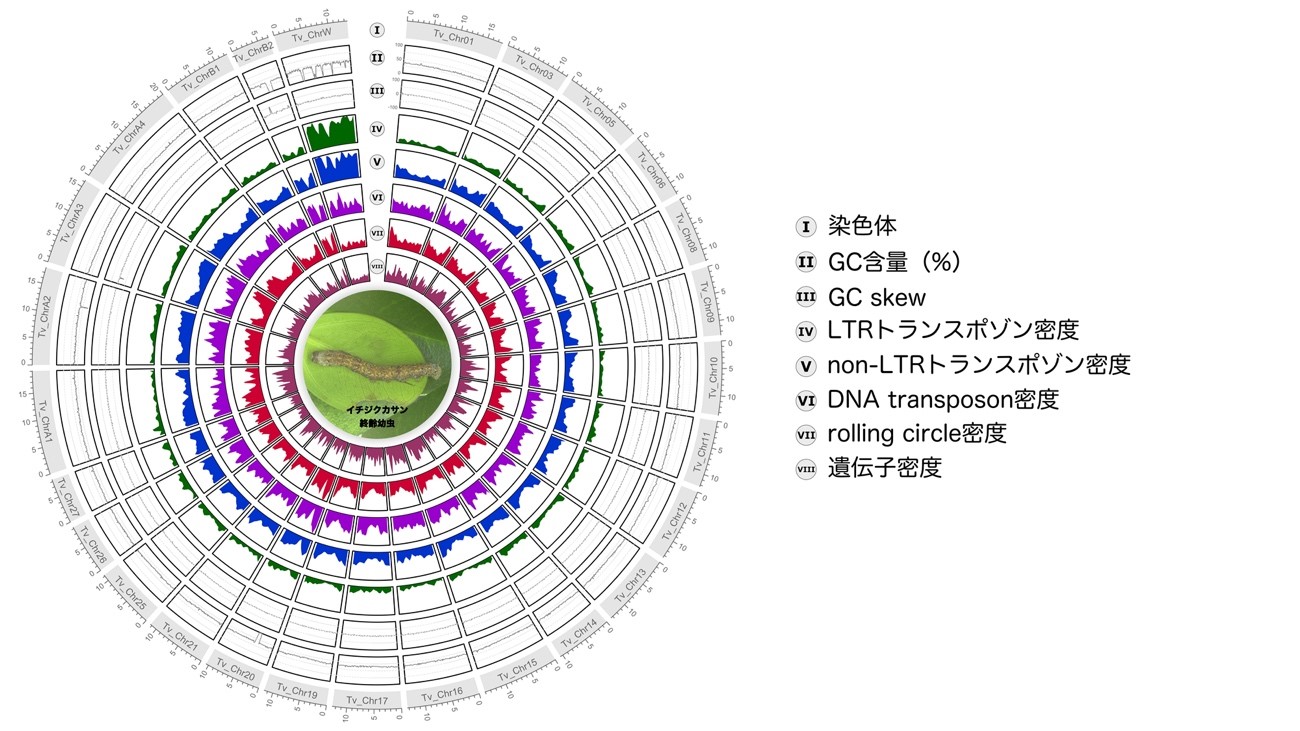
2025.01.28
【研究成果・プレスリリース】カイコガ科の野生種イチジクカサンの高精度ゲノムアノテーション情報を公開
-
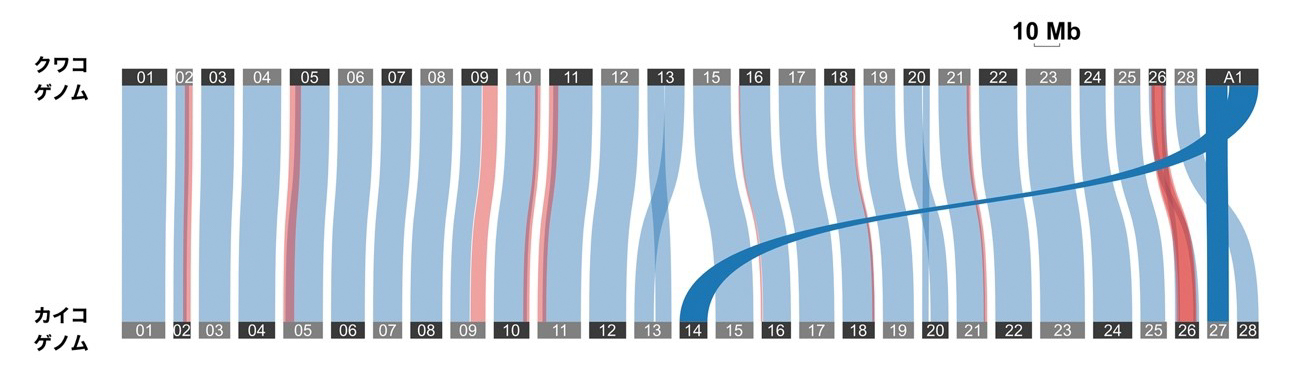
2025.01.20
【研究成果・プレスリリース】日本産クワコの染色体スケールのゲノム解読に成功
-

2024.11.22
プレスリリース】北海道大樹町、SPACE COTAN、学習院大学が宇宙利用分野における産官学連携協定を締結―地域社会の発展と宇宙人材の育成・学術の振興を図る―
-
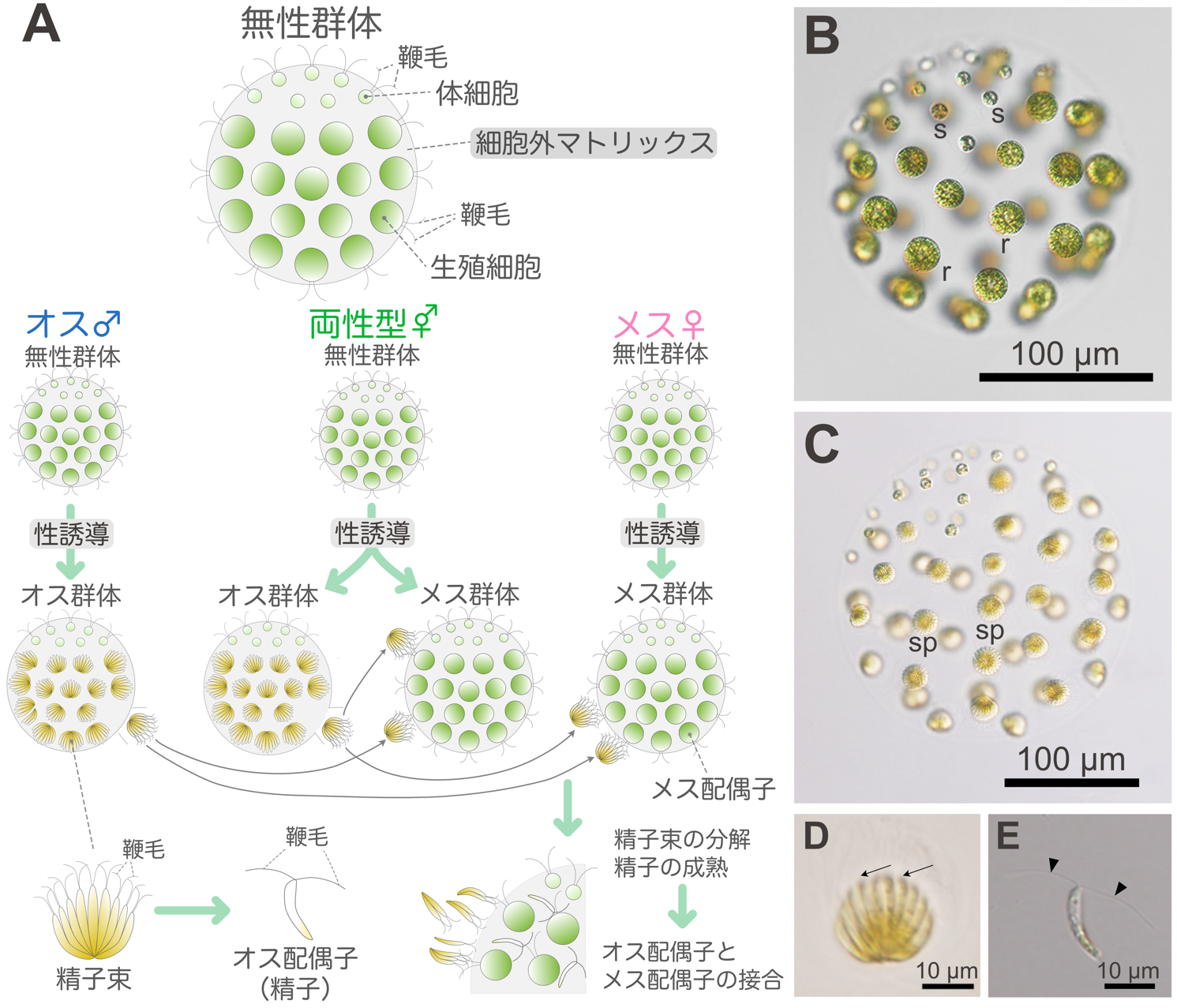
2024.09.09
【研究成果】群体性ボルボックス目緑藻精子束は速く泳ぐ ―プランクトン性藻類の有性生殖における鞭毛運動の意義を明らかに―






