【研究成果・リリース】DNA二本鎖切断の修復を時空間的に制御するメカニズムの解明
2024.01.16
DNA二本鎖切断の修復を時空間的に制御するメカニズムの解明
ポイント
- DNA二本鎖切断(DSB)を修復するDNA相同組換え機構の分子メカニズムを明らかにしました。
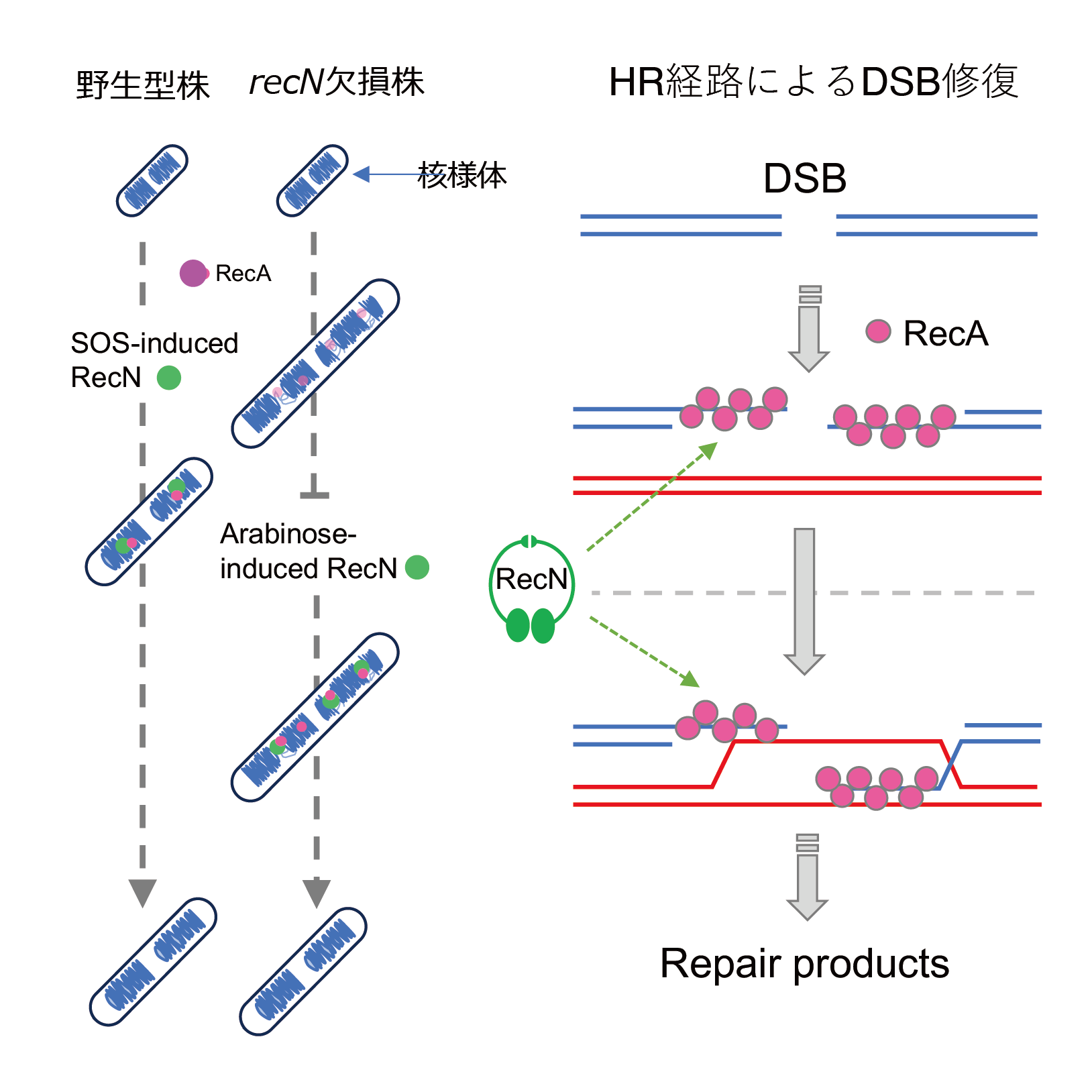
- DSBにより断片化した核様体(染色体に相当)を持つ大腸菌細胞において、SMCファミリーに属するRecNを人工的に発現させると核様体構造が正常な状態へ回復することを発見しました。
- RecNは断片化した核様体の間(ギャップ領域)に局在し、核様体の動態を制御することでRecAによるDNA相同組換え修復の促進に関与していることがわかりました。
- 核様体/染色体の動態制御がDNA組換え反応の促進に必須の役割を果たしていることが明らかになりました。
研究の概要
学習院大学大学院自然科学研究科の博士後期課程3年の野田俊輔さん、赤沼元気助教、毛谷村賢司元助教、菱田卓教授らの研究グループは、DNA二本鎖切断(DSB)を修復するDNA相同組換え機構の分子メカニズムを明らかにしました。
大腸菌のゲノムDNAは核様体と呼ばれる高次構造を形成しており、これは真核生物の染色体に相当します。SMC(染色体構造維持)ファミリーに属するRecNタンパク質は、核様体構造の安定性維持に関与し、DNA二本鎖切断(DSB)修復の促進に重要な役割を果たしています。しかし、RecNによる核様体の動態制御が、どのようにDSB修復を促進しているのかは不明でした。そこで本研究では、糖の1種であるアラビノースの添加により遺伝子発現が誘導される、PBADプロモーター※1の下流にRecN遺伝子を繋いだ発現制御系を用いて、DNA損傷ストレス下でRecNの発現タイミングが核様体の動態に及ぼす影響を詳細に調べました。
以前の研究から、DSB誘導剤であるマイトマイシンC(MMC)で処理した∆recN細胞では、核様体が断片化し細胞生存率が低下することが知られていましたが、興味深いことに、MMC処理後の∆recN細胞にアラビノースでRecNを誘導すると、断片化した核様体が正常な構造へと回復し、野生型細胞と同程度にまで細胞生存率が回復することがわかりました。同様の条件でGFPを融合したRecNを蛍光顕微鏡を用いて観察すると、GFP-RecNは断片化した核様体の間(ギャップ領域)で特異的な局在を示すフォーカスを形成し、さらに、この領域でDNA組換えタンパク質であるRecAと共局在していることがわかりました。また、生細胞を用いたGFP-RecNのタイムラプス蛍光観察から、RecNがフォーカスを形成しているギャップ領域において核様体構造の回復が起こることが明らかになりました。
これらの結果は、MMCで処理した∆recN細胞で観察された核様体の断片化は細胞死を伴う核様体の崩壊を示すものではなく、RecAを介したDSB修復のプロセスが中断された状態であることを示唆しています。これらの結果より、DSB修復時にRecAが関与する相同鎖の探索と鎖交換反応は時空間的に分離可能であり、RecNは核様体の動態を制御することによって、RecAによる組換え反応の促進に関与していることが明らかになりました。
本研究成果は2023年11月17日に国際学術誌Journal of Biological Chemistry誌のオンライン版に掲載されました。本研究は文部科学省科学研究費補助金の支援を受けて行われ、また本発表は学習院大学グランドデザイン 2039「国際学術誌論文掲載補助事業」より掲載費を助成しています。
研究の背景
生物が持つゲノムDNAは、様々な外的・内的要因によって常に損傷を受けています。DNA二本鎖切断(DSB)はその中で最も重篤な損傷であり、DSBが修復されない場合や不適切に修復された場合は、染色体レベルのゲノム不安定性が引き起こされ、これはヒトにおける発がんや老化の促進などの原因となっています。相同組換え(HR)は進化的に保存された機構であり、相同な配列を持つDNAを組換え及び修復合成の鋳型として用いることでDSB部位の正確な修復に関与しています。大腸菌では、RecAリコンビナーゼがHRによるDSB修復において中心的な役割を果たしており、RecAはDSB末端部の処理によって生じた一本鎖DNA領域にフィラメント状に結合し、細胞内で相同な配列を持つ二本鎖DNAを探索します。そして、RecAフィラメントが相同な二本鎖DNAと結合すると鎖交換反応を触媒し、組換え中間体が形成されます。このRecAによる組換え反応を促進するためには、細胞内空間において鋳型となる二本鎖DNAとRecAフィラメントが近接し、両者の結合が安定に維持されることが重要と考えられますが、その空間制御のメカニズムは不明な点が多く残されています。
SMC(染色体構造維持)ファミリーに属するタンパク質はすべての生物に存在しており、DNA複製時の姉妹染色体の接着や染色体の凝縮・分配の他、転写やDNA修復など、広範なDNA代謝機能において構造的な役割を果たしています。大腸菌recN遺伝子はDNA損傷に応答して発現が誘導されるSOS遺伝子群の1つで、SMCファミリーに属するタンパク質をコードしておりバクテリア間で高度に保存されています。大腸菌recN欠損(∆recN)細胞は、DSBを誘導する電離放射線やマイトマイシンC(MMC)に高い感受性を示し、MMC存在下では真核生物の染色体に相当する核様体の断片化が顕著に観察されます。また、これまでの生化学的解析から、RecNはRecAと物理的に相互作用し、RecAによる鎖交換反応を促進する活性を持つことがわかっています。これらの結果は、RecNがRecAによるDSB修復反応の促進に関与することを示唆しています。そこで、本研究では、RecNが持つ核様体の動態を制御する機能がDSB修復機構において果たす役割を明らかにするため、RecNの欠損で見られる細胞レベルの影響(核様体の断片化)と分子レベルの影響(HR経路の欠損)の関連性について詳細に解析を行いました。
研究の内容
以前の研究から、RecNはDNA損傷に応答して発現し、損傷部位周辺の姉妹染色体間を接着する活性(コヒーシン活性)を持つことが示されており、DNA損傷に応答したRecNの迅速な発現は、DSB修復時の核様体構造の維持に重要な役割を果たしていると考えられます。今回、研究グループは、RecNの発現タイミングが核様体の構造と生存率に及ぼす影響について調べるため、recN遺伝子が本来持っているDNA損傷に依存して発現誘導が起こるSOSプロモーターからアラビーノースの添加により発現を誘導できるPBADプロモーターに置き換えたRecN発現プラスミドを構築しました(図1)。
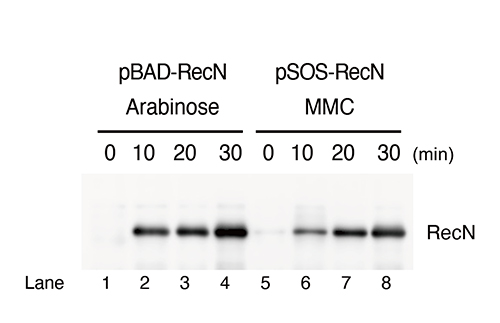
図1 RecN発現系の構築
pBAD-RecNまたはpSOS-RecNプラスミドで形質転換した∆recN細胞にアラビノースまたはMMCを加えて培養した。
RecNは抗RecN抗体を⽤いたウエスタンブロット法で検出した。
Lane 1~4: アラビノースによるRecNの発現
Lane 5~8: DNA損傷 (MMC) によるRecNの発現
このプラスミドで∆recN細胞を形質転換後、MMC処理開始直後にアラビノースを添加しRecNの発現誘導したところ、SOS誘導の場合と同様にMMC処理中も核様体構造は正常に保たれ、断片化は観察されませんでした。次に、MMC処理後90分の段階でRecNの発現誘導を行なったところ、90分の段階では∆recN細胞に特徴的な核様体の断片化が観察された一方で、120分(RecN誘導後30分)の段階では正常な核様体構造を持つ細胞の割合が増加し、細胞の生存率も野生型細胞と同程度まで回復が見られました(図2)。
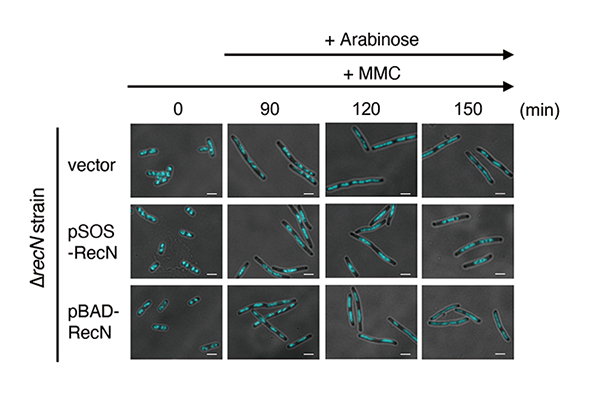
図2 MMC処理後の核様体構造
90分間MMC処理した形質転換細胞にアラビノースを加え、さらに60分間培養した。
各時間ごとのサンプルをDNA染⾊液(DAPI)で染⾊した。スケールバー: 2.5 µm
この結果は、DSBにより核様体の構造が損なわれた後でも、RecNの発現は核様体構造と細胞生存率を回復させることが可能であることを示しています。
SOS誘導型GFP-RecNは、DNA損傷に応答して核様体上にRecNの局在を示すフォーカスを形成することが知られています。本研究では、MMC処理後90分の段階でアラビノースによりGFP-RecNを発現誘導し、その細胞内局在について詳しく解析を行いました。その結果、GFP-RecNは主に断片化した核様体間(ギャップ領域)にフォーカスを形成することがわかり、これはDNA損傷直後の発現で見られる核様体上の局在とは対照的な結果となりました。この結果は、RecNのコヒーシン機能を欠いた細胞において、DSBによる核様体構造の局所的な破壊が核様体ギャップ形成を引き起こしていること、そしてRecNのギャップ領域への局在はDSB部位への結合を反映していることを示唆しています。さらに、MMC処理した∆recN細胞にRecNを発現した際の動態を生細胞を用いたライブイメージングにより解析したところ、RecNがフォーカスを形成した核様体ギャップ領域で核様体構造の回復が起こることがわかりました。このことから、核様体ギャップ領域に結合したRecNはDSB修復を促進することで核様体構造の回復を引き起こしていることが示唆されました。そこで、RecNがギャップ領域においてHR経路に関わるRecAと共局在しているか調べるため、GFP-RecNとRecA-mCherry※2の両方を発現する細胞を用いて蛍光観察を行いました。その結果、核様体の断片化が生じた∆recN細胞において、RecAはギャップ領域でフォーカスを形成し、さらにアラビノースによって発現が誘導されたRecNはギャップ領域でRecAと共局在していることがわかりました(図3)。
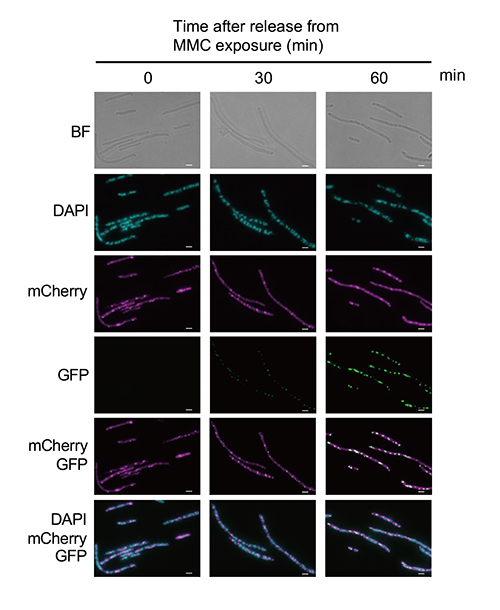
図3 RecNとRecAの細胞内局在
pRecA-mCherryとpBAD-GFP-RecNで形質転換した∆recN細胞にMMCを加えて90分間培養した(0 min)。その後、MMCを取り除くと同時にアラビノースを加えてさらに60分間培養した。各時間ごとのサンプルを蛍光顕微鏡を⽤いて解析した。スケールバー: 2.5 µm RecA-mCherry; マゼンダ、GFP-RecA; 緑、DNA; ⻘
以上の結果より、∆recN細胞で見られる断片化した核様体は、不可逆的な核様体の崩壊を示すものではなく、RecAによるHRプロセスが中断された状態を反映したものであり、RecNはRecA依存的にギャップ領域に結合することでRecAによるHR反応を活性化しDSB修復の促進に関与していることが明らかになりました(図4)。
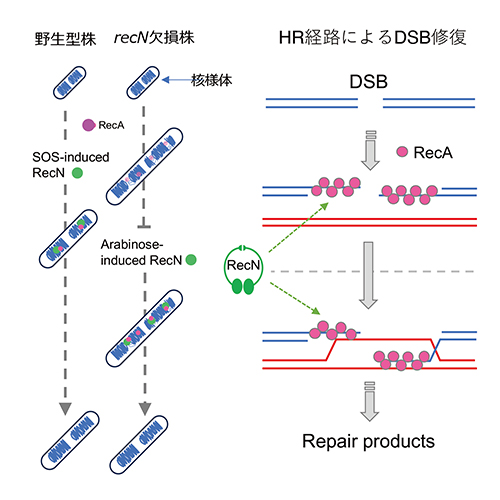
図4 HR経路におけるRecNの役割
左:RecNは核様体の断片化が生じた後で発現した場合でも正常な核様体に回復させることができる
右:RecNが持つDNA鎖間結合活性は、RecAフィラメントによる相同鎖探索から鎖交換反応に至る過程の構造的基盤として機能している
今後の展開
今回の結果は、RecAが持つ2つのHRプロセス、すなわちRecAフィラメントによる相同鎖探索とDNA鎖交換反応が時間的・空間的に分離可能であり、SMC様のRecNがRecAフィラメントと核様体の両者の動態を制御することによって一連の反応を促進する必須の役割を果たしていることが明らかになりました。今後は、精製タンパク質とDNAを用いた生化学実験によって、RecNによるRecAのHR反応の制御メカニズムを分子レベルで明らかにしていきたいと考えています。
用語解説
*1 プロモーター
遺伝子の転写に関与するRNAポリメラーゼが結合するDNA領域。SOSプロモーターとPBADプロモーターは、プロモーター近傍の制御配列も含めた名称。
*2 GFPとmCherry
GFPとmCherryは、それぞれオワンクラゲとイソギンチャクモドキから単離されたタンパク質。励起および蛍光波長が異なり、GFPは緑の蛍光(509nm)、mCherryは赤い蛍光(610nm)を発するため、同一細胞内で同時に観察できる。
論文情報
論文名:RecN spatially and temporally controls RecA-mediated repair of DNA double-strand breaks
雑 誌:Journal of Biological Chemistry
著者名:Shunsuke Noda, Genki Akanuma, Kenji Keyamura, Takashi Hishida
DOI :10.1016/j.jbc.2023.105466
発表者
野田 俊輔 学習院大学自然科学研究科生命科学専攻 博士後期課程3年
赤沼 元気 学習院大学理学部生命科学科 助教
毛谷村 賢司 学習院大学理学部生命科学科 元助教
菱田 卓 学習院大学理学部生命科学科 教授