【研究成果・共同プレスリリース】タウ蓄積の新たなスイッチを発見!~ジスルフィド結合の形成をブロックすることで、認知症での神経細胞死を抑制!?~
2021.06.21
タウ蓄積の新たなスイッチを発見!
~ジスルフィド結合の形成をブロックすることで、認知症での神経細胞死を抑制!?~
Disulfide bond formation in microtubule-associated tau protein promotes tau accumulation 3 and toxicity in vivo
研究体制:
東京都立大学 同志社大学 学習院大学
【概要】
認知症は、認知機能に障害が生じる病気であり、脳の神経細胞が徐々に死滅していくアルツハイマー病などの神経変性疾患によって引き起こされます。これらの神経変性疾患の多くには、タウと呼ばれるタンパク質が脳に蓄積することが病理的な特徴として見られ、それらの疾患は総称して「タウオパチー」と呼ばれます。タウは、正常な脳では、脳の細胞の中で支柱やレールとなる微小管という構造を作る役目をしています。しかし、これらの病気では、タウは通常と異なる構造になり、本来の機能を失った異常なタウが蓄積して、神経細胞を傷害します。タウは色々な構造をとって存在するので、タウのどのような変化が最も神経細胞死に関わるのかは、はっきりしていませんでした。
今回、東京都立大学大学院理学研究科生命科学専攻の斉藤太郎助教と安藤香奈絵准教授らは、同志社大学生命医科学部医生命システム学科の宮坂知宏准教授、学習院大学理学部生命科学科の高島明彦教授と共に、タウの蓄積を引き起こすスイッチとなる新たな変化を見つけました。タウの中のこのスイッチ(ジスルフィド結合)部分をブロックすることで、有害なタウが溜まるのを防ぎ、タウオパチーでの神経細胞死を抑制することができる可能性があります。
この成果はHuman Molecular Genetics誌のオンライン版にて発表されました。
(論文URLはこちら https://academic.oup.com/hmg/advance-article-abstract/doi/10.1093/hmg/ddab162/6302471?redirectedFrom=fulltext)
【ポイント】
○タウ病変を特徴とする神経変性疾患(タウオパチー)の発症における、酸化ストレスと神経細胞死をつなぐ分子メカニズムの一つが明らかになった。
○タウの中にある二つのシステインは、神経細胞内で酸化されるとジスルフィド結合を作る。
○ジスルフィド結合を作るとタウは蓄積し、神経細胞死を引き起こす。
○ジスルフィド結合の形成を阻害すると、タウは速やかに分解され、神経細胞死が抑制される。
【研究背景】
タウの多くは特定の構造を持たず、正常な脳では、微小管に結合してその安定性を制御しています。しかし、疾患をもつ脳では、タウはさまざまな構造をとっています。複数のタウが重合し、ついには不溶性の繊維構造を形成して蓄積しています。これまでに、タウの量が増えると神経細胞死が起きやすくなることと、タウが構造変化することにより毒性をもつことはわかっていました。また、疾患脳で見られる酸化ストレスの増加などの細胞内の変化が、こういったタウの異常を引き起こすと考えられています。しかし、タウの構造変化の分子機構、また構造変化と毒性の関係は、完全には分かっていませんでした。
【研究詳細】
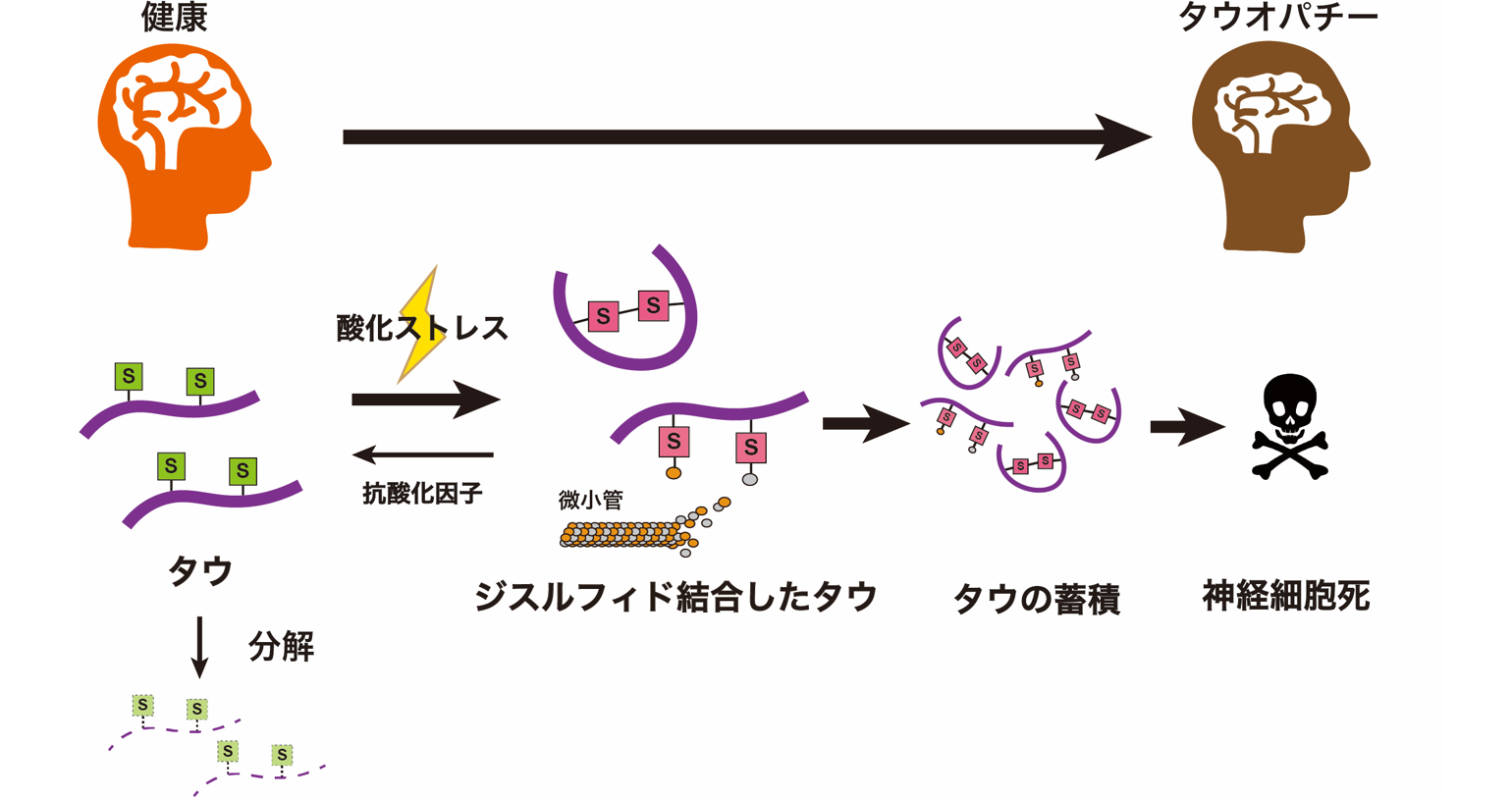
細胞は老化や疾患により、酸化ストレスという状態になります。これは、活性酸素種の産生に対して抗酸化機構が追いつかず、活性酸素種が細胞の構成分子を酸化させてしまう状況です。活性酸素種がタンパク質の構成成分であるアミノ酸の一つ、システインを酸化させると、分子間または分子内で架橋構造(ジスルフィド結合)ができます。タウにもシステインが2つ存在します。私たちは、この2つのシステインがジスルフィド結合を作ることが、タウ蓄積のスイッチとなることを見つけました。
マウスの神経細胞やショウジョウバエの脳にヒトのタウを発現させると、タウの中にあるシステインは酸化されてジスルフィド結合を作りました。このジスルフィド結合ができないようにすると、タウは分解されやすくなりました。このことから、タウの中のシステインが酸化されるとジスルフィド結合が作られることで、タウが溜まりやすくなることが分かりました。ショウジョウバエの視神経細胞にヒトのタウを発現させると細胞死がおきますが、ジスルフィド結合ができないタウを発現させたところ、神経細胞死は起きませんでした。さらに、タウが微小管を伸ばす機能についても、タウのシステインのジスルフィド結合が関わっていることも分かりました。
これらの結果から、疾患をもつ脳の神経細胞では、酸化ストレスへの対応がうまくいかず、活性酸素種などによりタウのシステインが酸化されジスルフィド結合を作り、タウ自身の構造が変化することで、蓄積しやすくなることが分かりました。また、このシステイン酸化型のタウは、微小管やその構成分子との結合も正常なタウとは異なり、蓄積することで神経細胞を傷害すると考えられます。
また、上記のジスルフィド結合に加え、タウの分解には影響を与えずに、毒性を下げる変異も見つけました。タウは普段は曖昧な構造を取っていますが、患者脳では繊維化して凝集したものが見られます。この繊維構造の核となる部分(PHF6)と、その近くで繊維化を補助すると考えられる部分(PHF6*)を欠損させると、毒性は大きく減少しました。しかし、システインの変異の場合とは異なり、タウの量は変わらなかったので、これらはタウの量ではなく性質のみを変えて無毒化していると考えられます。
【研究の意義と波及効果】
本研究の成果から、タウオパチーにおいてタウが蓄積し神経を傷害することにつながる分子スイッチが明らかになりました。今回使ったショウジョウバエタウオパチーモデルでの神経細胞死は、タウの病変の初期段階を模していると考えられます。そのため、タウのジスルフィド結合形成は、疾患につながるタウの変化の中でも初期段階に起きるものであり、神経細胞死を効果的に抑えられる戦略につながる可能性があります。今後、タウのシステインや抗酸化作用に注目した創薬開発の可能性が広がると期待されます。