アルツハイマー病を通して脳の老化の本態に挑む

アルツハイマー病の名を聞いたことのない人は少ないだろう。認知症をもたらす病の1つだが、あたかも認知症の代名詞のような使われ方さえされている。実際、日本での認知症の原因としては、現在はアルツハイマー病が最も多いとされている。1906年にアルツハイマー病が最初に報告されてからすでに1世紀以上がたつが、何がどうなってこの病に至るのか、そのプロセスに関してはまだあまりよくわかっていない。その解明に挑んでいるのが理学部生命科学科の高島明彦教授だ。
教授室のホワイトボードは、文字や記号、矢印でびっしりと埋め尽くされていた。左上から右下へと書かれているわけではなく、いくつかの語句のまとまりが時に重なりあっている。簡単なグラフもある。高島教授の頭の中のアイデアや知識が、そこには文字として現れていた。その情報量に圧倒された。
写真を撮ってウェブに載せても大丈夫ですかと尋ねると、ホワイトボードをしばらく眺めながら「左上だけは出さないでください。あれは、まだ論文にしていない。あとは......ええ、大丈夫です」。いかにも第一線の研究者らしいお返事だ。すでに論文で発表した成果やアイデアは構わないが、未発表のものは自分が論文にするまで公開しないでほしいという意味だ。
ホワイトボードの文字や記号のすべてを理解できたわけではないが、メインテーマが、あるタンパク質であることはわかった。アルツハイマー病の原因ではないかとみられているものだ。
脳に"ゴミ"がたまってしまう
アルツハイマー病の患者の脳では、異常な状態になったタンパク質が溜まっていることが知られている。これはしばしばゴミが溜まった状態にたとえられている。どんな家でも古くなってくれば、拭いても落ちない汚れがついていたりする。これとは別に、たとえば豪雨で浸水すれば、家は一気に汚れるだろう。アルツハイマー病はどちらに近いのだろう。長期にわたって少しずつゴミが溜まる状態と、異常事態でゴミだらけになる状態と。
「私はだんだんとゴミが溜まっていくようなものではないかなと考えています。まだわかりませんよ。でも、そう考えています」と高島教授はいう。
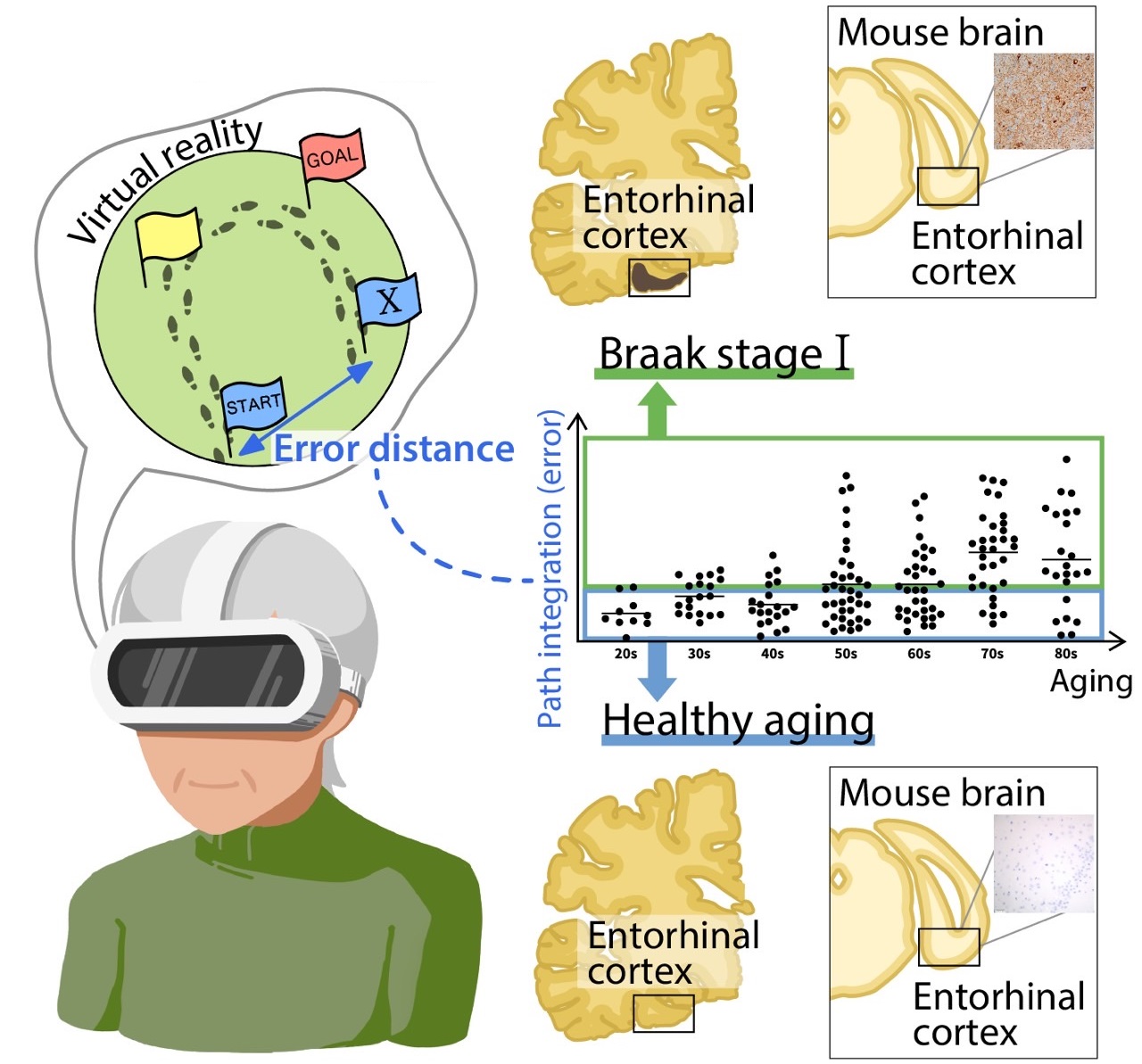
どこから溜まり始めるのかはわかっている。大脳の奥の方にある「嗅内皮質」という場所が最初だ。記憶の座である脳の海馬と、目や耳からの情報を処理する大脳新皮質の感覚野をつないでいる部分で、ひんぱんに情報のやりとりがある。ここに最初にゴミが溜まり始めるのも「いつも使われているからでしょう。これも推測ですが」と高島教授。
50代では半数くらいの人で、すでに嗅内皮質にゴミが溜まり始めているという。言葉が出てこなくなって、「ほら、あれだよ、あれ」と言うのが増えてくるのは、その兆候だ。ただ、この段階はいわば"正常な老化"で認知症ではない。
事態が深刻になっていくのは、ゴミの溜まる場所がだんだんと広がって、大脳新皮質に至ってからだ。大脳新皮質にゴミが溜まり始めると、これは食べられるかどうかといった判断力や、こうすると何が起きるかといった推理力、さらには怒りを抑えるなどといった能力までが損なわれてくる。
高島教授は症状が進んでしまってから、治療によって改善させるのは難しいとみている。アルツハイマー病の患者さんの脳では、ゴミが溜まっているだけでなく、おそらくはゴミが溜まったせいでニューロン(神経細胞)が死んでしまっているからだ。
私たちの身体をつくっている細胞の中には、皮膚の細胞や血液の細胞のように、日々、新しい細胞ができて古くなった細胞と入れ替わるタイプもあれば、滅多なことでは入れ替わりが起きないタイプもある。ニューロンは入れ替わりが起きないタイプとして知られており、死んでしまうと補充はされない。だからこそ、大脳新皮質のニューロンが死に始める前に手を打たなければならないのだ。
「(嗅内皮質にゴミが溜まり始めて)言葉がすぐに出てこなくなって、「あれ」が増えても、会話はできるし、身の回りのことも趣味を楽しむこともできる。そこで食い止めればいいんです」と高島教授は言う。

脳の細胞を死なせるゴミはどっち?

高島教授との会話で出てきた"ゴミ"は、「タウ」というタンパク質が異常な状態に凝集して糸くず状になったものだ。専門家は「神経原線維変化」と呼んでいる(末尾に「変化」とあるので現象をさす用語に思えてしまうが、糸くず状の物体を指す言葉)。
実は、アルツハイマー病の脳ではもうひとつ別の種類の"ゴミ"が知られている。「アミロイドβ(ベータ)」というタンパク質が沈着して「老人斑」という特徴的なシミとなる。老人斑という名称のわかりやすさもあって、こちらの方が知られているかもしれない。
ニューロンを死滅させる犯人は異常なタウなのか、アミロイドβなのか──この数十年のアルツハイマー病研究は、これを突き止めることだといっても過言ではない。
20世紀末から今世紀初頭まで、有力視されていたのはアミロイドβのほうだった。高島教授も現在でこそタウに注目しているが、当初はアミロイドβに的を絞って研究していた。それにはもちろん理由がある。
アルツハイマー病は家系とはあまり関係なく現れるが、ごくまれに、比較的若いうちに症状が現れる患者さんを出す家系がある。こうした家族性アルツハイマー病の方々の遺伝子を調べたところ、アミロイドβのもととなるアミロイド前駆体をつくる遺伝子に変異が見つかった。1990年代に得られた研究成果だった。
真犯人の最有力候補となったことで、アミロイドβの沈着を防ぐ薬の開発が行われた。とはいえ、アミロイドβが沈着すると、なぜニューロンが死滅するのかはわかっていなかった。培養皿に入れたニューロンにアミロイドβを加えると、たしかに細胞は死ぬ。でも、そのプロセスがわからない。高島教授は、それを解明しようと、脳でアミロイドβの蓄積が盛んになるように遺伝子を改変されたマウスの脳を観察した。ところが──。
犯人は老人斑ではなかった
「あれっ、と思った。死なないじゃないか、って」。そのマウスの脳を調べたときのことを高島教授はこう振り返る。老人斑はたくさんできていたが、ニューロンはそれほど死滅していなかった。「アミロイドβだけでは、ニューロンは死なないのではないか」。このマウスでは、タウが凝集した糸くず状の神経原線維変化もなかった。老人斑はあって、神経原線維変化はなく、ニューロンの死亡もない。高島教授はアミロイドβ犯人説に疑いをもち、もう1つの候補であったタウに注目するようになる。
以来、高島教授はずっとタウに注目した研究を続ける。タウに関する遺伝子組み換えマウスを次々と作り、タウがアルツハイマー病でどういう役割を演じようとしているかを明らかにする研究を発表した。2001年の遺伝子組み換えマウスを使った研究こそ、海外のライバルに競争で負けてしまったが、「マウスの作成は私たちの方が早かったはず」と高島教授。その後も、2002年、2007年、2010年とタウに関する遺伝子組み換えマウスを作成、重要な発見を発表し続け、その勢いは今も続いている。
しかし、学界全体としてはアミロイドβ真犯人説の勢力がすぐに衰えたわけではない。とくに日本ではアミロイドβが優勢の状態が続いた。「10年前、私たちは世界のトップにいた。あそこで皆がタウに注力していれば、日本はトップになれたのに」と高島教授は悔しがる。

アミロイドβ犯人説を崩す決定的ともいえる論文が発表されたのは2008年のこと。臨床医学では最高峰とされる学術誌Lacetに英国のグループが載せたもので、8人の患者にアミロイドβの沈着を防ぐ薬を投与していた長期研究の結果だった。その内容は世界中のアルツハイマー病研究者を驚かせた。
8人のうち7人では、最も深刻なレベルまで認知症状が進んでしまっていた。しかも、亡くなった後の脳を見ると、老人斑がまったくない人もいたのだ。薬でアミロイドβの沈着を防ぐことには成功していたのに、認知症状の進行を抑えることはできなかったのだ。
さらに最近になって、タウが脳のどこにどのくらい溜まっているのかを患者さんで直接、画像診断として調べることが可能になった。すると、アルツハイマー病の進行の程度とタウの蓄積に相関があることがはっきりとした。やはり、より直接的に関係しているのはタウの方だったのだ。
タウに何が起きている?
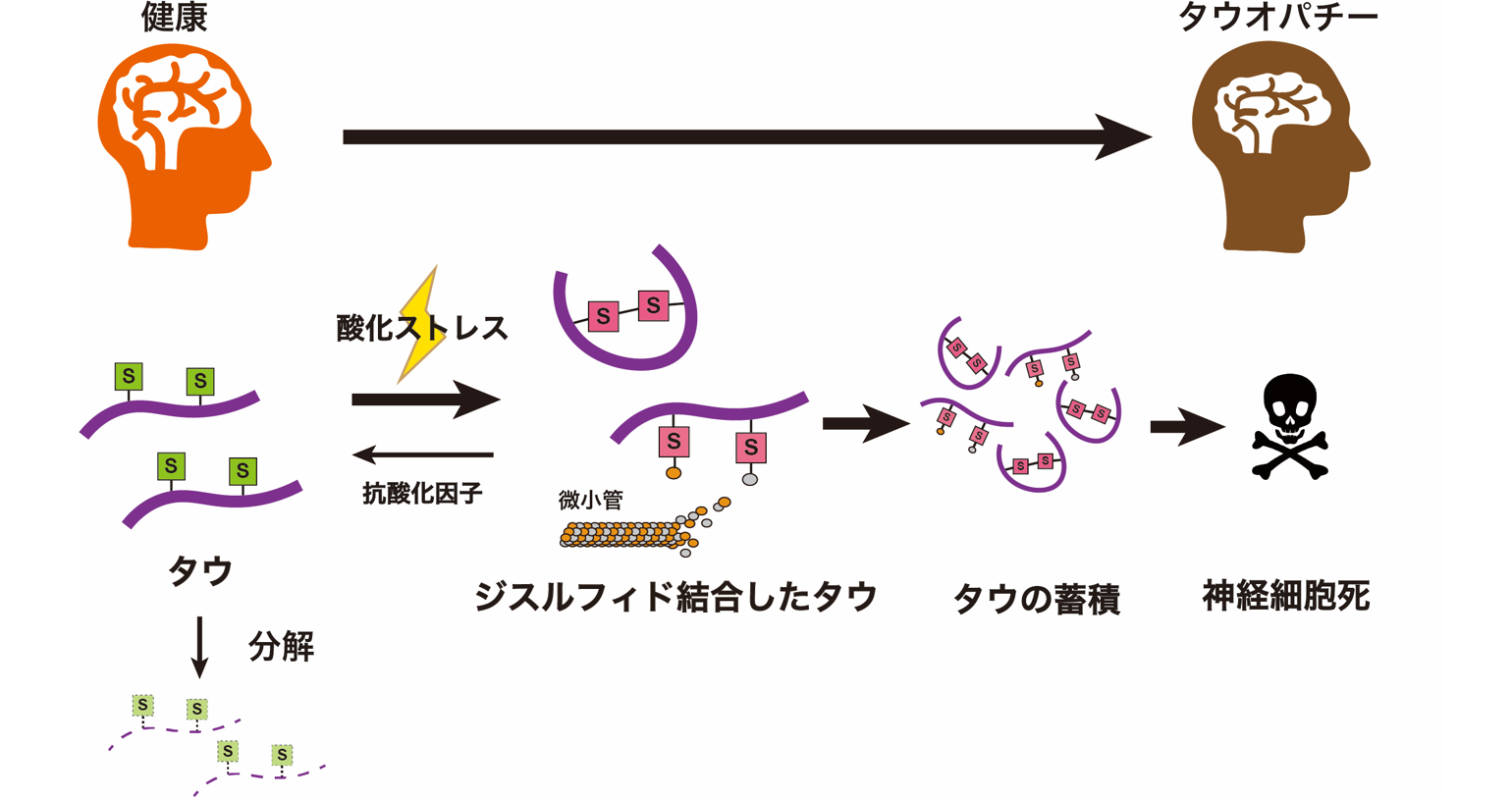
早くから研究の舵をタウに切っていた高島教授は、タウが神経原線維変化として細胞内に溜まるまでのプロセスを明らかにしてきた。高島教授やほかの研究グループのこれまでの研究から、以下のような段階を経ることがわかっている。
まず、タウがリン酸化される(タウにリン酸がくっつく)。次に、単体のリン酸化タウがいくつか集まってかたまりになる。こうなると、水溶性だったタウは水には溶けない不溶性へと変わり、細胞の中に糸くず状のゴミ、つまり神経原線維変化として現れてくるようになる。
最初のステップがタウのリン酸化だとわかると、では、それを食い止めようという試みが始まった。
ニューロンの中で、タウに自然にリン酸がつくことはなく、そこにはリン酸をつける酵素が働く。その酵素の働きを阻害してリン酸化を食い止めれば、タウが神経原線維変化になることはなくなり、認知症状の進行も抑えられるのではないか──。とはいえ、その酵素を抑えたせいで、ほかに不都合が生じるようでは元も子もない。高島教授はこう考え、タウをリン酸化する酵素の遺伝子がなくなった遺伝子欠損マウスを作って、試すことにした。
生まれてきたマウスは健康そうに見えた。ところが、年をとると妙なことが起き始めた。すぐ前にあったことが覚えられなくなっていたのだ。どうやら、タウをリン酸化する酵素はある程度の年齢になってから新しいことを覚えるのには不可欠らしい。
「リン酸化する酵素があると、いずれはタウが凝集してニューロンが死んでしまう。でも、この酵素がないと年をとってから新しいことが覚えられなくなってしまう」と高島教授はいう。このリン酸化酵素の働きを抑える薬が開発できたとしても、さじ加減がとても難しい薬になりそうだ。「それはね、医療の現場では使えないってことなんです」。タウのリン酸化を抑えようという手法は、きっぱりと断念した。
リン酸化を抑えるのではなく、タウそのものをなくしてしまおうという研究もある。しかし、その手法には高島教授は反対だ。「生き物の身体なのだから、何か役割があってそこに(タウが)あるはずです。その役割を知らないままそれをなくそうとは......生物学者としてはそのアイデアは受け入れられない」と熱がこもる。

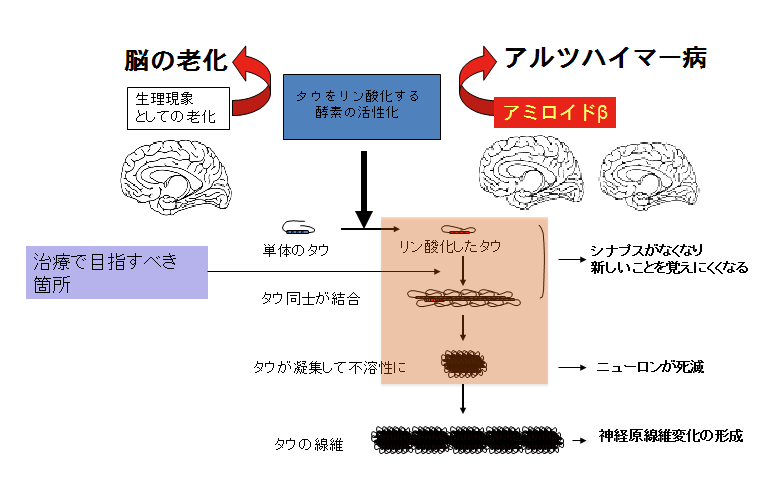
アルツハイマー病の治療で目指すべき箇所
高齢になるにつれて、大脳の奧にある嗅内野と呼ばれるところでタウをリン酸化する酵素の働きが活発になり、神経原線維変化ができてくる。これが脳老化の始まりの状態だ(左)。一方、アルツハイマー病の脳では、ものごとの判断などをするのに重要な新皮質で、アミロイドβが凝集し、シミのような老人斑ができる。この時、新皮質のニューロンでタウのリン酸化とタウ同士の結合が起き、細胞内に沈着してしまう。こうなると、新皮質のニューロンは死滅してしまい、認知症状が現れる。リン酸化したタウが互いに結合する段階を防げば、ニューロンの死滅も防げ、認知症の進行も抑えられるはずだ。
高島教授が次に手がけたのは、単体のタウがいくつも集まって一塊になる最後のステップを食い止める方法を見つけ出すことだった。タウ同士がくっつくのを邪魔する物質を見つけるには、タウとタウがくっつく前にタウとくっつく物質を探せば良いはずだ。実に6600ものさまざまな化合物を試した結果、不整脈やぜん息の発作などが起きたときに薬として使われているイソプロテノールという物質がタウとくっつくことがわかった。
次にすべきは、生き物での実験だ。タウが脳で溜まりやすくなるように遺伝子を組み換えたマウスに、イソプロテノールを3カ月にわたって飲ませた。飲ませていなかったマウスでは、脳にタウのゴミが溜まってニューロンが死んでしまっていたが、薬を飲ませていたマウスでは、タウのゴミは減っていた。それも飲ませていた量に応じて減っていた。これを発表したのは2015年12月のこと。学習院大学に就任する直前のことだった。
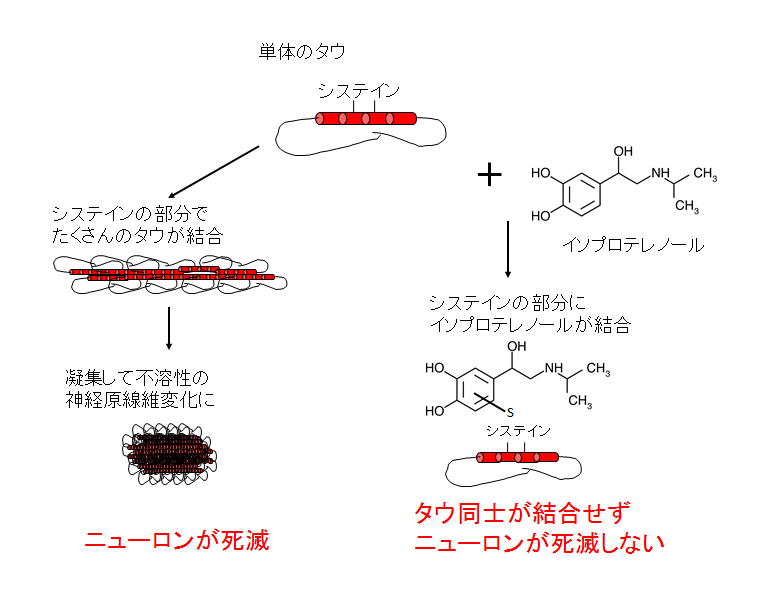
タウの凝集の仕組みとそれを食い止める手法
ニューロンの中にあるタウは、内部にあるシステインの箇所でほかのタウと結合し、凝集して不溶性の神経原線維変化となる。こうなるとそのニューロンは死んでしまう(左)。イソプロテレノールという化合物は、タウのシステインの箇所に結合することでタウ同士がくっつき合うことを防ぎ、結果としてニューロンの死滅も抑えられる(右)。
なぜニューロンが死ぬのかを解明したい

ここまで来れば、次は薬の開発のように思える。イソプロテレノールは不整脈などへの薬としてすでに使われているから、安全性の確認はできているように思える。しかし、「それほど単純ではないですよ。アルツハイマー病の進行を抑える薬にするならば、長期服用となります。長期服用の安全性はまだわかっていません」と高島教授はいう。
さらには、マウスでの実験のように口から飲んでも、人間では脳に届くかどうかもわからないという。脳は、血液中にある異物が混入してくるのを防ぐために「脳血液関門」というバリヤーで守られている。このため、薬を飲んだり、注射したりしても、脳には届かないということがよくある。マウスでは飲ませるだけで脳に届いていたのだから、人間でも脳血液関門を通りそうな気もするが──。
「そう思いますよね。でも、それがそうじゃない。マウスでは通っても、人で通れるかどうかはわからない。サルで試せば良いかというと、これもダメ。サルでは通れなかったのに、人では通ったなんて例もあります。こればっかりは、(人で)試してみないとわからない」。
人で試すとなると、それはいわゆる臨床研究となる。「それは、ほかの方にお任せしてもいいかなと思っているんです」。高島教授が学習院大学で所属しているのは、医学部ではなく理学部だ。薬の開発よりも、もっとニューロンの死の本質に迫りたいという。「(タウの神経原線維変化があると)なぜニューロンが死ぬのか、そもそもどういう死に方をするのか、それがまだわかっていない。それを突き止めたい」。
高島教授によれば、そもそもニューロンの"死に方"については謎が多いという。一般に、細胞の死に方には大きく分けて2種類ある。1つは、細胞が自ら自身を死なせる方法で、いったん"死のスイッチ"が入ると整然と進み、周囲の細胞たちへのダメージもない。もう1つは、激しいダメージがあったときに起きる死に方で、整然と死ぬことさえできなくなったときに生じると考えられている。
では、アルツハイマー病のときにニューロンが死んでいくのはどちらのタイプだろう。「わからないんですよ、それが」。正常な老化でもニューロンは死んでいくが、それとアルツハイマー病でのニューロンの死に方が同じなのかどうかもわからないという。
皮膚の細胞の寿命はせいぜい1カ月、血液の細胞では数カ月だが、細胞の新旧交替のないニューロンの場合、事実上、その人と同じ年齢を経ていることになる。だから、高齢になると病気とは無関係に少しずつニューロンは死んでいく。同じ人の脳でもいっせいに起きるわけではなく、個人差も大きい。「あるニューロンが、あとどのくらい生きられるのか、そういう指標になるものを探したいのです」と高島教授は言う。
血液の細胞などでは、あと何回くらい細胞分裂ができるかを示す物質的な指標があり、テロメアと呼ばれている。それを調べれば細胞の老化を知る目安となっている。けれども、分裂をしないニューロンではテロメアは細胞老化の目安にならない。「何かが溜まっていくとか、何かが減っていくとか、何かがあるはずなんです。ニューロンがあとどのくらい生きられるかの目安になるものが」。
それを見つければ、その指標をもとにニューロンを長生きさせる薬や食事、生活習慣なども客観的に評価できるようになる。そうなって初めて私たちは、脳の老化とはいったいどういうことなのかを理解することになるだろう。高島教授の挑戦は続く。
(科学ライター・詫摩雅子)
Profile
高島 明彦
AKIHIKO TAKASHIMA
1954年長崎県に生まれる。1979年に九州大学理学部生物学科を卒業、81年に同大学院で修士課程修了、87年に九州大学で理学博士号を取得。米国立衛生研究所(NIH)、三菱化成生命科学研究所主任研究員などを経て、97年より理化学研究所脳科学総合研究センター・アルツハイマー病研究チームリーダー、2011年より、国立長寿医療研究センター認知症先進医療開発センター分子基盤研究部長。2016年4月より学習院大学理学部生命科学科教授。

詫摩 雅子
MASAKO TAKUMA(聞き手・ライター)
初等科より学習院に入り、女子部に学ぶ。生物学科に進むため、他大学に入学。修士課程を修了後、1990 年に日本経済新聞社に入社。科学技術部記者、科学雑誌「日経サイエンス」の記者・編集者を経て、2011年に日本科学未来館に。日経サイエンスに掲載したSTAP細胞に関する一連の記事に対し、2015年の医学ジャーナリスト協会大賞を共著者の古田彩氏(日経サイエンス)と共同受賞。