【研究成果・共同プレスリリース】ミトコンドリア酵素MITOLの低下は心臓老化や心筋梗塞を増悪し、 MITOLの活性化は心筋梗塞の重症化を抑制する
2022.07.20
学習院大学
自治医科大学
ミトコンドリア酵素MITOLの低下は心臓老化や心筋梗塞を増悪し、
MITOLの活性化は心筋梗塞の重症化を抑制する
1.発表者:
| 徳山剛士 | 自治医科大学再生医学研究部 博士研究員 東京薬科大学生命科学部 助教(当時) |
| 椎葉一心 | 学習院大学理学部生命科学科 助教 |
| 伊藤直樹 | 学習院大学理学部生命科学科 研究員 |
| 稲留涼子 | 学習院大学理学部生命科学科 研究員 |
| 柳茂 | 学習院大学 理学部 生命科学科 教授 東京薬科大学 名誉教授 |
2.研究体制:
魚崎英毅 自治医科大学、杉浦歩 順天堂大学(当時、東京薬科大学)、西躰元 東京薬科大学、 武田啓佑 東京薬科大学、長島駿 東京薬科大学、 天羽拓 防衛大学校、毛利聡 川崎医科大学、西村明幸 九州大学/自然科学研究機構生理学研究所、西田基宏 九州大学/自然科学研究機構生理学研究所、今野歩 群馬大学、平井宏和 群馬大学、石戸聡 兵庫医科大学、吉沢隆浩 信州大学、新藤隆行 信州大学、高田真吾 北翔大学、絹川真太郎 九州大学
3.発表のポイント:
- ミトコンドリアの形態と機能を調節する酵素MITOLをマウスの心筋で欠損させると、心臓老化が誘導され半年以内に全て心不全を発症した。
- MITOL欠損による心臓老化及び心機能障害は、ミトコンドリア分裂因子Drp1の過剰な活性化によるミトコンドリアの形態異常が主な原因である。
- 心筋梗塞モデルマウスにMITOL遺伝子ベクターを心筋に送達してMITOLの発現を増加させると心筋梗塞の病態が大幅に改善した。
- 以上より、MITOLはDrp1の制御を介して心臓老化や虚血ストレスから心筋細胞を保護しており、MITOLの減少が心臓老化や心筋梗塞の増悪に関与することから、MITOLが治療の標的になる可能性を示した。
4.発表の概要:
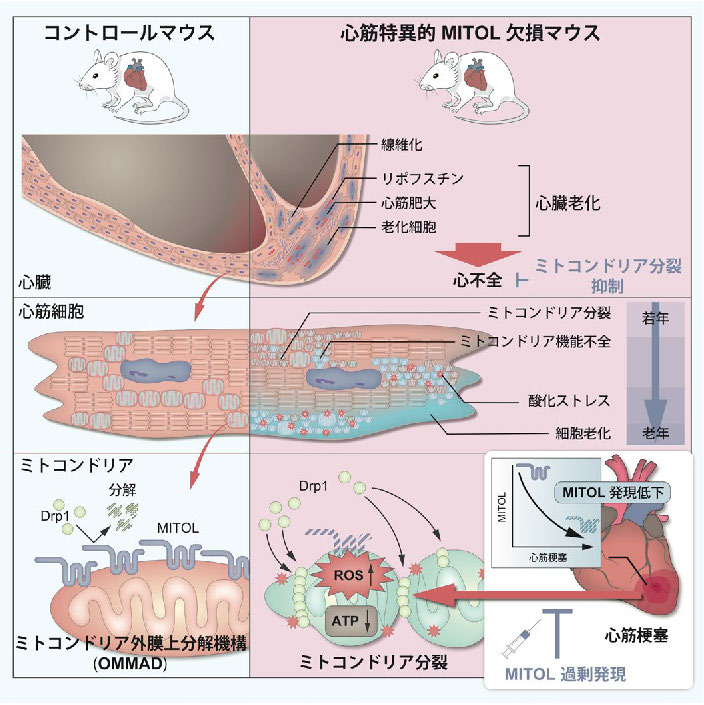
自治医科大学の徳山剛士博士研究員と学習院大学の柳茂教授のグループは、東京薬科大学、群馬大学、九州大学、自然科学研究機構生理学研究所、信州大学、防衛大学校、北翔大学との共同研究で、ミトコンドリアに存在する酵素ミトコンドリアユビキチンリガーゼMITOLの減少によるミトコンドリアの形態異常が、心臓老化による心不全や心筋梗塞による心筋壊死を引き起こすことを示唆し、MITOLがこれらの病気の治療標的になる可能性を示しました。
心不全は未だ予後不良の病気であり、心筋梗塞は心筋が壊死して死に至ることも多い、恐ろしい病気です。それゆえ効果的な治療法の開発が待ち望まれています。心不全や心筋梗塞の病態において、ミトコンドリアの機能低下が原因の一つとして注目されていますが、その実態は不明です。柳らの研究グループは、ミトコンドリアユビキチンリガーゼMITOLを同定し、MITOLがミトコンドリアの形態と機能を調節する中心的な酵素であることを報告してきました。特に、MITOLはミトコンドリア分裂因子であるDrp1を抑制してミトコンドリアの分裂を防いでいることがわかっていましたが、生体内での意義は不明でした。興味深いことに、マウスの心臓において加齢と共にMITOLの発現が有意に減少し、逆にDrp1がミトコンドリアに集積してミトコンドリアの分裂が亢進していることを見出しました。そこで、MITOLの減少によるDrp1の活性化が心臓老化を引き起こしているのではないかと考え、薬剤誘導型の心筋特異的MITOL欠損マウスを作成し検証しました。その結果、MITOL欠損により早期から心臓老化が誘導され、すべてのマウスは半年以内に心不全を発症してその後、死に至ることがわかりました。予想通り、Drp1の蓄積によるミトコンドリアの過剰な分裂が観察されたので、Drp1の阻害剤を投与したところ、心臓老化や心機能障害が改善されました。さらに、心筋梗塞モデルマウスやヒトの心筋梗塞患者の心筋においても、MITOLの顕著な減少が観察されました。MITOLの減少が心筋壊死の原因ではないかと考え、MITOL遺伝子を挿入したアデノ随伴ウイルスを心筋に投与しMITOLの発現を増加させたところ、心筋梗塞の病態が大幅に改善しました。これらの研究成果により、MITOLはDrp1を制御することにより心臓老化や虚血ストレスから心筋細胞を保護しており、MITOLの減少が心臓老化による心不全や心筋梗塞による心機能障害に深く関与していると考えられます。今後、心不全や心筋梗塞に対してMITOLを標的とした治療法の開発が期待されます。
本研究成果は、2022年6月10日(米国夏時間)にiScience誌のオンライン版に掲載されました。
本研究は、日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」及び文部科学省科学研究費補助金の支援を受けて行われました。また、学習院大学グランドデザイン 2039「国際学術誌論文掲載補助事業」より掲載費を助成しています。
5.発表内容:
【研究の背景】心不全は、心臓のポンプ機能が悪くなり、体に充分な血液を送り出せなくなった状態で、予後がよくない病気です。心不全は加齢とともに発症リスクが上昇する加齢関連疾患の一つであり、心臓老化が心不全の発症や増悪の基盤になっています。心臓老化は、心筋梗塞や心筋症、高血圧症などの種々のストレスが慢性的に心筋に負荷されることによって促進すると考えられていますが、その実態は未だよくわかっていません。心筋梗塞は、心筋に血流を送る冠動脈が閉塞することによって血流が途絶え、酸素が不足した心筋が壊死して死に至ることも多い怖い病気です。それゆえ、心不全や心筋梗塞に対しての効果的な治療法の開発が望まれています。一方、これまでに心不全の病態にミトコンドリアの形態異常が関与していることが報告されています。心不全患者や心不全モデルマウスの心臓においてミトコンドリア分裂因子Drp1が蓄積していることや、Drp1の特異的阻害剤を心不全モデルマウスに投与すると心不全の症状が改善することから、Drp1の毒性が心不全の増悪に関与していることが示唆されていました。しかしながら、なぜ心不全においてDrp1が過剰に活性化してしまうのか不明でした。柳らのグループは、ミトコンドリア外膜に局在するユビキチンリガーゼMITOLを同定し、MITOLがDrp1をユビキチン化することにより、Drp1の分解を促進することを細胞実験で明らかにしていましたが、生体内での役割は不明でした。そこで、今回、心不全および心筋梗塞の病態に着目し、MITOLによるDrp1制御の生理的意義の解明を行いました。
私たちは、ミトコンドリア外膜を4回貫通するE3ユビキチンリガーゼMITOLを同定し、MITOLがミトコンドリア分裂因子Drp1の制御をはじめミトコンドリアの形態と機能を調節していることを報告してきました。今回、老齢マウスの心筋でDrp1によるミトコンドリアの形態異常が観察されたこと、MITOLが加齢と共にマウスの心臓や他の臓器で減少することから、MITOLの減少によるDrp1の過剰な活性化が心臓老化を誘発し、心不全の発症に関与しているのではないかと考えました。その仮説を検証するために、薬剤誘導型の心臓特異的MITOL欠損マウスを作成したところ、Drp1の蓄積(図1A)とミトコンドリアの断片化が観察されました(図1B)。
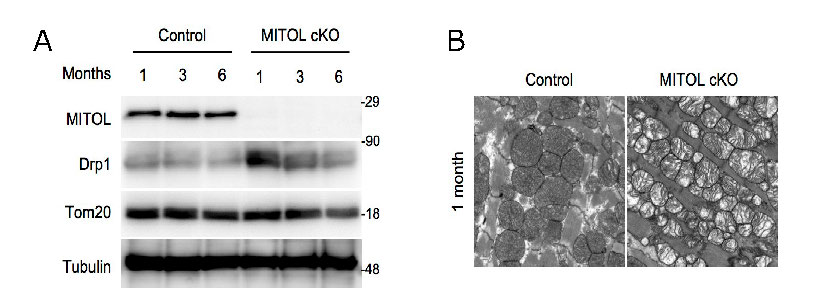
図1 MITOLを欠損したマウス心筋におけるDrp1の蓄積とミトコンドリアの形態異常
A: MITOL欠損によるDrp1の蓄積
B: MITOL欠損によるミトコンドリアの形態異常(電子顕微鏡観察)
心筋におけるミトコンドリアの呼吸活性は高度に低下しており、ミトコンドリアでのエネルギー合成は著しく低下していました。ミトコンドリア画分においても酸化タンパク質が著しく増加しており、活性酸素種による酸化ダメージの亢進が認められたことから、心筋老化を引き起こしているのではないかと推察いたしました。そこで、老化マーカーであるβ-ガラクトシダーゼの染色を行ったところ、β-ガラクトシダーゼ染色領域は拡大しており(図2A)、広範なリポフスチンの沈着(図2B)や線維化の亢進(図2C)も観察されました。このマウスは最終的に心不全を発症し(図2D)、半年から10ヶ月以内に全て死に至っています。
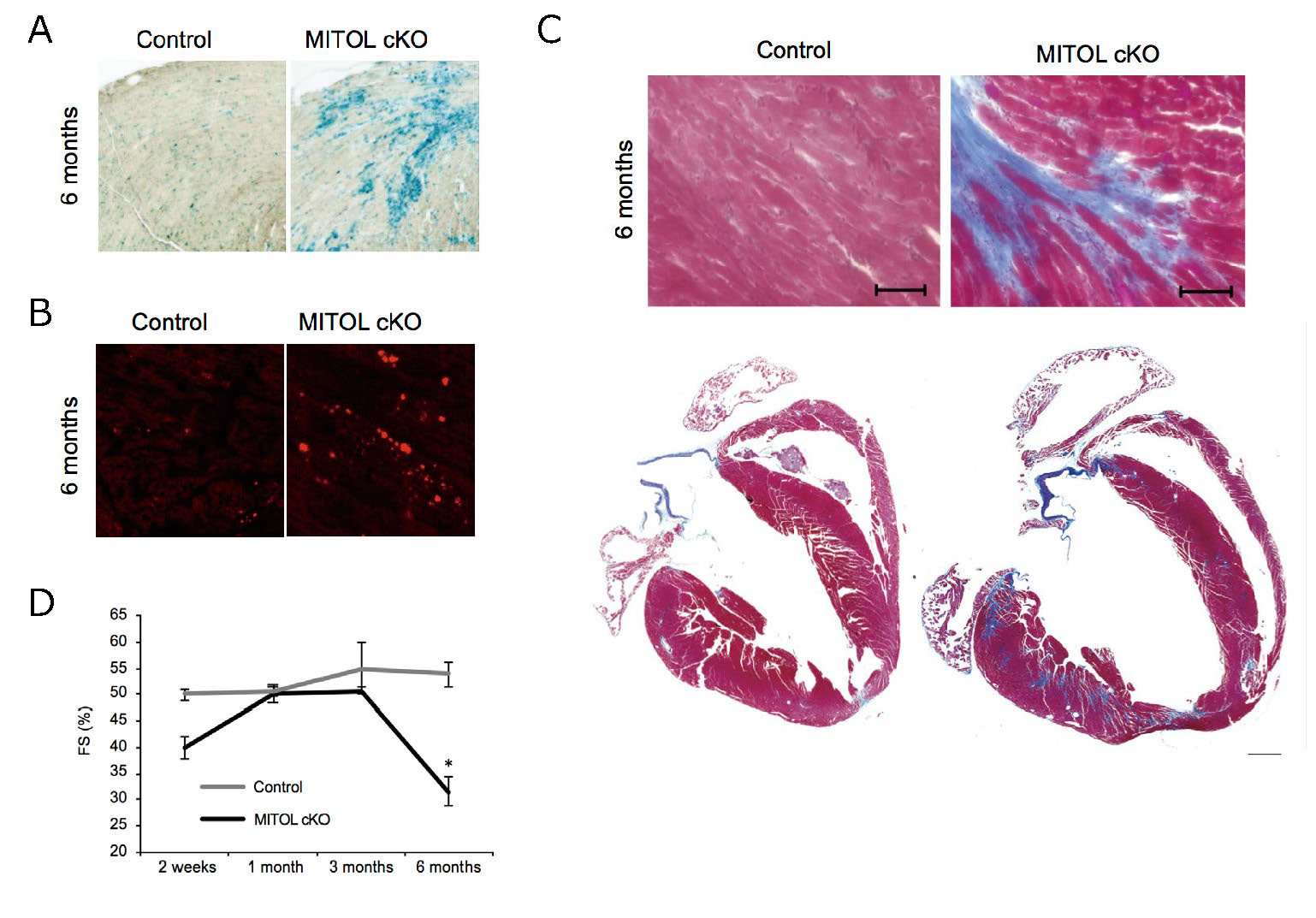
図2 MITOL欠損による心臓老化の亢進と心不全の発症
A: MITOL欠損によるβ-ガラクトシダーゼ(老化マーカー)染色領域の拡大
B: MITOL欠損によるリポフスチンの沈着
C: MITOL欠損による繊維化の亢進(マッソントリクローム染色:コラーゲン結合組織繊維を検出)
D: MITOL欠損による心不全の発症(FS%:左室内径短縮率%)
Drp1の蓄積によるミトコンドリアの形態変化が主な原因ではないかと考え、Drp1の阻害剤 (Mdivi-1) を腹腔内に投与すると、Drp1のミトコンドリア移行は抑えられました(図3A)。すると、β-ガラクトシダーゼ染色領域(図3B)および線維化領域も縮小したことから(図3C)、Drp1によるミトコンドリアの形態異常が心臓老化を引き起こしたことが示唆されました。これらの結果により、MITOLはDrp1を制御することにより心臓老化を抑制しており、MITOLの減少がDrp1の過剰な活性化を引き起こし、ミトコンドリア機能低下による酸化ストレスの増大が心臓老化と心不全の発症を誘導したと考えられました。
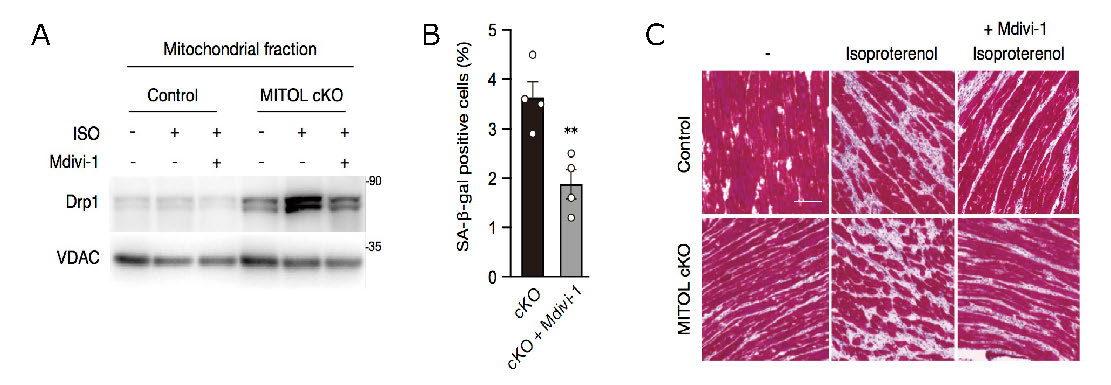
図3 Drp1阻害剤による心負荷MITOL欠損心筋の心臓老化の抑制および繊維化領域減少
A: MITOL欠損心筋においてイソプロテレノール心負荷誘導によるDrp1のミトコンドリア移行は、Drp1阻害剤Mdivi-1の腹腔投与により有意に抑制される。
B, C: MITOL欠損心筋においてDrp1阻害剤Mdivi-1の投与により心負荷誘導型の心臓老化(B, β-ガラクトシダーゼ染色)および繊維化の亢進は有意に抑制される(C, マッソントリクローム染色)
さらに、心筋梗塞モデルラットおよび心不全患者の心臓においても、MITOLの顕著な減少が観察されたことから(図4)、MITOLの減少が心筋壊死の原因になったのではないかと考え検証を行いました。心筋梗塞モデルラットにMITOL遺伝子を挿入したアデノ随伴ウイルスを直接注入して心筋特異的にMITOLの発現を増加させました。すると、心筋梗塞の病態が大幅に改善されました(図5)。これらの研究成果により、MITOLはDrp1を制御することにより虚血ストレスから心筋細胞を保護しており、MITOLの減少が心筋梗塞による心機能障害に深く関与していることが示されました。
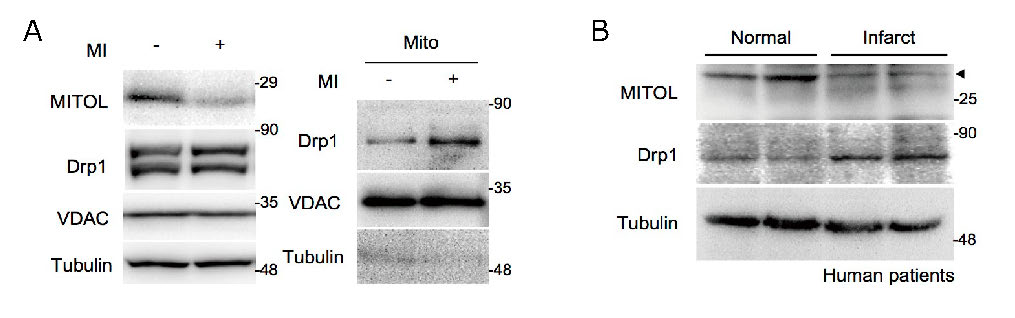
図4 虚血ストレスによるMITOL発現の低下
A: ラットの心筋梗塞モデルにおけるMITOLの発現低下とDrp1の増加。コントロールラットはsham手術したもの。
B: ヒトの心筋梗塞患者の心筋におけるMITOLの発現低下とDrp1の増加。コントロールは心臓に疾患のない心臓のサンプル。心筋梗塞患者の心筋サンプルは非梗塞部領域のもの。患者の年齢は全て60代半ばのものを使用。
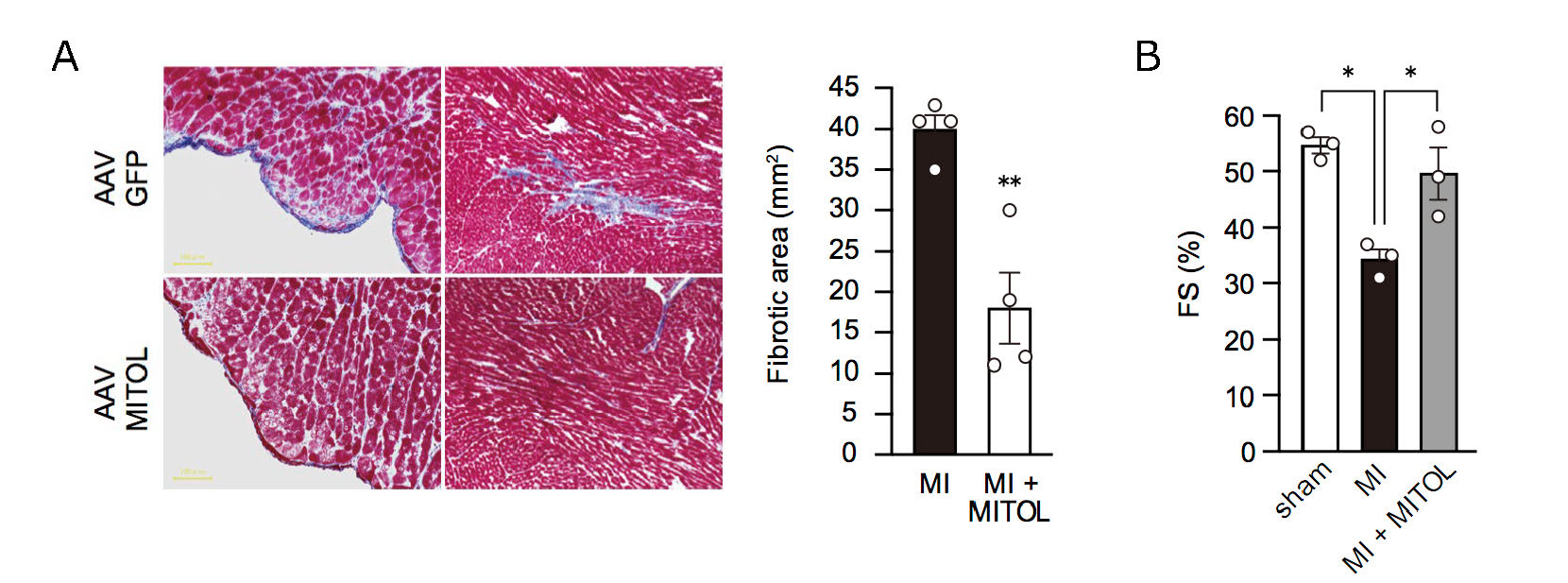
図5 MITOL遺伝子ベクターによる心筋梗塞の病態改善
A: 心筋梗塞モデルマウスの術後2日目にアデノ随伴ウイルスにMITOLベクターを直接注入し、心筋特異的にMITOLの発現を増加させると繊維化が有意に抑制された。ウイルス注入後14日目にサンプルを調整し解析した。
B: MITOL遺伝子ベクターにより心筋梗塞の誘導による心機能の低下も顕著に抑制された。
【今後の展望】
実際に一部の心不全患者においてMITOLの減少が示唆されていますが、まだサンプル数が少なくはっきりとしたことが断定できませんでした。今後は多くの心不全患者の病態においてMITOLの減少やDrp1の活性化、ミトコンドリアの形態異常などを確認する必要があります。今回の研究成果により、心不全や心筋梗塞に対してMITOLを標的とした治療法の開発が期待されます。現在、MITOLの発現を増やす薬剤をスクリーニングしており、すでにいくつか候補化合物が同定されています。これらの薬剤が心不全や心筋梗塞をはじめ様々な老化疾患の治療薬になる可能性が期待されます。
6.発表雑誌:
| 著者 | : | Takeshi Tokuyama, Hideki Uosaki, Ayumu Sugiura, Gen Nishitai, Keisuke Takeda, Shun Nagashima ,Isshin Shiiba ,Naoki Ito ,Taku Amo ,Satoshi Mohri, Akiyuki Nishimura, Motohiro Nishida, Ayumu Konno, Hirokazu Hirai, Satoshi Ishido, Takahiro Yoshizawa, Takayuki Shindo, Shingo Takada, Shintaro Kinugawa, Ryoko Inatome, and Shigeru Yanagi 徳山剛士、魚崎英毅、杉浦歩、西躰元、武田啓佑、長島駿、椎葉一心、伊藤直樹、天羽拓、毛利聡、西村明幸、西田基宏、今野歩、平井宏和、石戸聡、吉沢隆浩、新藤隆行、高田真吾、絹川真太郎、稲留涼子、柳茂 |
| 論文タイトル | : |
Protective roles of MITOL against myocardial senescence and ischemic injury partly via Drp1 regulation |
| 雑誌名 | : | iScience |
| 掲載日 | : | 2022年6月10日(米国東部標準時(夏時間)/EDT) |
| DOI | : | 10.1016/j.isci.2022.104582 |
| 論文URL | : | https://www.cell.com/iscience/fulltext/S2589-0042(22)00854-9 |
7.お問い合わせ先:
【研究に関すること】
学習院大学 理学部 生命科学科 分子生化学
教授 柳 茂(やなぎ しげる)
E-mail: shigeru.yanagi@gakushuin.ac.jp
自治医科大学 分子病態治療研究センター 再生医学研究部
博士研究員 徳山剛士(とくやま たけし)
E-mail: tokuyama.t@jichi.ac.jp
【取材に関すること】
学習院大学 学長室広報センター(担当 川崎)
東京都豊島区目白 1-5-1
Tel:03-5992-1008
E-mail:koho-off@gakushuin.ac.jp
自治医科大学 大学事務部・研究支援課(担当 山田)
栃木県下野市薬師寺 3311-1
Tel:0285-58-7550
E-mail:shien@jichi.ac.jp
8.用語解説:
|
1)MITOL (Mitochondria Ubiquitin Ligase) |
: | ミトコンドリア外膜を4回貫通するE3ユビキチンリガーゼ。MARCHファミリーに属しておりMARCH5とも呼ばれる。ミトコンドリア外膜近傍の標的タンパク質にユビキチンを付加することでタンパク質の分解を誘導したり、タンパク質の局在や活性を調節している。ミトコンドリアの形態制御や品質管理を担っている。 |
| 2)Drp1(Dynamin-relatedprotein,Dlp1ともよばれる) | : |
ミトコンドリアを分裂させる因子。不活性化型は主に細胞質に局在しており、リン酸化などにより活性化するとミトコンドリア外膜に移行し、重合することによりミトコンドリアを分裂させる。 |
| 3)FS値(%) | : |
左室内径短縮率%。左心室の収縮機能を評価する指標の一つで、心エコーを用いて左室拡張末期径と左室収縮末期径を計測し、両者の差を左室拡張末期径で除し、100 分率で表した値。左心室の収縮機能が亢進していれば高値を示し、収縮機能が低下していれば低値を示す。 |
| 4)アデノ随伴ウイルスベクター | : | アデノ随伴ウイルスベクター(AAVベクター)は増殖/非増殖のいずれの細胞にも遺伝子導入が可能であり、特に非分裂細胞においては長期間の目的遺伝子発現が可能である。アデノウイルスベクターやレトロウイルスベクターと比較して、免疫原性が低く、動物個体への遺伝子導入にも適している。 |